Medisinsk ekspert av artikkelen
Nye publikasjoner
Hypofyseanemi (dvergvekst)
Sist anmeldt: 12.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Begrepet "hypofysdvergisme" (fra gresk nanos - dverg; syn.: dvergisme, nanosomia, mikrosomia) betyr i absolutt forstand en sykdom, hvis viktigste manifestasjon er en kraftig veksthemning, assosiert med et brudd på utskillelsen av veksthormon av den fremre hypofysen.
I bredere forstand er dvergvekst en forstyrrelse i vekst og fysisk utvikling, hvis forekomst ikke bare kan forårsakes av en absolutt eller relativ mangel på somatotropisk hormon på grunn av patologi i selve hypofysen, men også av en forstyrrelse i hypothalamus (cerebrale) regulering av dens funksjoner, defekter i biosyntesen av somatotropisk hormon og forstyrrelser i vevsfølsomhet for dette hormonet.
Fører til dvergvekst
De fleste former for hypofysedvergvekst er genetiske sykdommer. Den vanligste er panhypopituitær dvergvekst, som hovedsakelig arves recessivt. Det antas at det finnes to typer overføring av denne formen for patologi - autosomal og gjennom X-kromosomet. Ved denne formen for dvergvekst, sammen med en defekt i utskillelsen av somatotropisk hormon, forstyrres oftest utskillelsen av gonadotropiner og tyreoidstimulerende hormon. Utskillelsen av ACTH forstyrres sjeldnere og i mindre grad. Funksjonelle studier med frigjørende hormoner, inkludert syntetisk somatotropinfrigjørende hormon (bestående av 29, 40 og 44 aminosyrerester), som ligner på pankreatisk polypeptid, har vist at de fleste av disse pasientene har patologi på hypothalamusnivå, og insuffisiens i den fremre hypofysen er sekundær. Primær patologi i selve hypofysen er mindre vanlig.
Genetisk dvergvekst med isolert veksthormonmangel, med nedsatt biologisk aktivitet og følsomhet for det, forekommer sporadisk i Russland og nabolandene. Det er mer vanlig på det amerikanske kontinentet, i landene i Nærøsten og Midtøsten, og i Afrika. Basert på resultatene fra en studie av blodinnholdet av somatotropisk hormon og pasientenes følsomhet for eksogent somatotropisk hormon, nivået av immunreaktivt insulin (IRI), insulinlignende vekstfaktorer (IGF) type I (somatomedin C) og type II, og responsen av IGF-1 på behandling med somatotropiske hormonpreparater, er ulike varianter av klinisk lignende typer dvergvekst identifisert.
Nylig har patogenesen til Laron-dvergvekst, som er forårsaket av mangel på IRF-1 og IRF-II, blitt dechiffrert, samt patogenesen til dvergvekst hos afrikanske pygmeer, assosiert med mangel på førstnevnte.
I 1984 ble en ny variant av pseudo-hypofysisk dvergvekst med et høyt nivå av somatotropisk hormon og IGF-1 beskrevet; opprinnelsen til dvergvekst forklares av en defekt i reseptorene, noe som bevises av en kraftig reduksjon i bindingen av hudfibroblaster til IGF-1.
Det bør understrekes at i moderne forhold, med tilstedeværelsen av små familier, kan mange isolerte («idiopatiske», sporadiske) tilfeller av sykdommen også være genetiske.
I analysen av 350 sykehistorier var etiologien til dvergvekst uklar hos 228 pasienter (65,2 %). Denne gruppen inkluderte pasienter fra 57 familier med gjentatt forekomst av dvergvekst (2–4 tilfeller per familie), som utgjorde 28 % av alle pasienter. I 77 % av familiene med etiologisk uklare (for det meste genetiske) former for dvergvekst ble det fastslått en ubestridelig sammenheng med arv av fravær av Rh-faktor. Fordelingen av Rh-faktor i familier med pasienter med dvergvekst er forskjellig fra den som observeres ved Rh-konflikten mellom mor og foster, og er som regel ikke ledsaget av hemolytisk sykdom hos den nyfødte (faren kan være Rh-negativ, og ved heterozygositet hos foreldrene for Rh-faktoren – hos barna, osv.). Det er mulig å anta en sammenheng mellom aktiviteten til gener som er ansvarlige for syntesen av somatotropisk hormon (eller somatotropinfrigjørende hormon) og gener som bestemmer Rh-faktoren, spesielt siden de fleste former for dvergvekst og fravær av Rh-faktor er autosomalt recessive egenskaper. Dette forklarer ikke den relative sjeldenheten av dvergvekst sammenlignet med hyppigheten av Rh-negative individer i befolkningen. Sannsynligvis er noen hittil ukjente tilleggsfaktorer viktige, men det er usannsynlig at fordelingen av Rh-faktoren i familier med pasienter med familiær og sporadisk dvergvekst er tilfeldig.
En stor gruppe pasienter med dvergvekst (primær cerebral, cerebral-hypofyse) er pasienter med ulike typer organisk patologi i sentralnervesystemet som oppsto i livmoren eller i tidlig barndom. Det anatomiske substratet som forårsaker denne patologien kan være underutvikling eller fravær av hypofysen, dens dystopi i patologien til dannelsen av sella turcica, cystisk degenerasjon av hypofysen, dens atrofi på grunn av kompresjon av en svulst (kraniofaryngeom, kromofob adenom, meningeom, gliom). Dvergvekst kan være forårsaket av traumatiske skader på hypothalamus-hypofyseregionen (intrauterin, fødsel eller postnatal), noe som ofte forekommer i flerlingsgraviditeter, så vel som under fødsel i seteleie, fotstilling eller i tverrgående stilling med rotasjon på beinet (dette er fødselsmekanismen hos mer enn 1/3 av pasientene med dvergvekst). Infeksiøse og toksiske skader er viktige (intrauterine virusinfeksjoner, tuberkulose, syfilis, malaria, toksoplasmose; sykdommer i tidlig alder, neonatal sepsis, meningo- og araknoencefalitt, etc.). Disse prosessene kan skade selve hypofysen, hypothalamussentrene som regulerer dens funksjon, og forstyrre normale funksjonelle forbindelser i sentralnervesystemet.
Intrauterine fosterlesjoner kan føre til fødsel av pasienter med «dvergvekst fra fødselen» med normal utskillelse av veksthormon (cerebral primordial dvergvekst, mikrocefali, Silver-Russell-dvergvekst med kroppshemiasymmetri og høye nivåer av gonadotropiner, etc.).
Ytterligere faktorer som forverrer bruddet på fysisk utvikling ved dvergvekst kan være utilstrekkelig ernæring, ubalansert med hensyn til essensielle ingredienser (proteinmangel) og mikroelementer (sinkmangel), og ugunstige miljøforhold, samt ulike kroniske sykdommer, som glomerulonefritt, der azotemi påvirker aktiviteten til leverreseptorer eller direkte påvirker metabolismen av leverceller, noe som forårsaker en reduksjon i syntesen av somatomedin, eller levercirrhose, når dannelsen av somatomedin er svekket.
Patogenesen
Hos de fleste pasienter med hypofysedvergvekst er endringene ikke begrenset til patologi i utskillelsen av somatotropisk hormon og følsomhet for det, men strekker seg til andre tropiske hormoner i hypofysen, noe som forårsaker ulike kombinasjoner av endokrine og metabolske forstyrrelser.
Ved isolert mangel på somatotropisk hormon har morfologiske endringer i hypofysen blitt dårlig studert. I de studerte tilfellene ble patologiske lidelser sjelden funnet (kraniofaryngeom eller hyperostose av kraniebenene). Ved denne typen dvergvekst kan man observere medfødt underutvikling av peptiderge celler eller en defekt i nevrotransmittersystemet i hypothalamus. I slike tilfeller kan dvergvekst kombineres med dysplasi eller hypoplasi av synsnervene. Intrasellære cyster, hypofyse- og hypothalamustumorer fører til STH-mangel, noe som forårsaker kompresjon av hypofysevevet, spesielt somatotrofer.
Dvergvekst kjennetegnes av tynning av beinvevet, hovedsakelig på grunn av det kortikale laget, forsinket differensiering og ossifikasjon av skjelettet. De indre organene er hypoplastiske, noen ganger atrofiske, og musklene er dårlig utviklet.
Symptomer dvergvekst
En kraftig forsinkelse i vekst og fysisk utvikling er de viktigste manifestasjonene av hypofysedvergvekst. Pasienter blir født med normal kroppsvekt og lengde og begynner å bli tregere i vekst fra 2–4 år.
Før aktiv behandling for nanisme ble dverger ansett som personer med en høyde på mindre enn 120 cm for kvinner og 130 cm for menn. For tiden avviker høyden til en dverg med minst 2–3 sigmaavvik fra den gjennomsnittlige tabellnormen for et gitt kjønn, alder eller populasjon. Det finnes også en metode for grafisk vurdering av høyde basert på den gaussiske fordelingskurven. I dette tilfellet inkluderes dverger etter høyde i en gruppe som inkluderer minimumsantallet individer i den tilsvarende populasjonen med størst etterslep fra den gjennomsnittlige vekstnormen.
Hypofysdvergvekst kjennetegnes ikke bare av liten absolutt kroppsstørrelse, men også av liten årlig vekst og fysisk utviklingsdynamikk. Kroppsbygningen er proporsjonal, men kroppens proporsjoner er typiske for barndommen hos pasienter. Huden er blek, ofte med et gulaktig skjær, tørr, noe som skyldes absolutt eller relativ skjoldbruskkjertelsvikt, noen ganger observeres cyanose - "marmorering" av huden. Hos ubehandlede pasienter oppstår gammeldags og rynkete hud (geroderma) tidlig. Dette skyldes utilstrekkelig anabolsk virkning av STH og langsom endring av cellegenerasjoner.
Håret på hodet kan være normalt eller tørt, tynt, sprøtt; lange øyevipper er typiske. Sekundær hårvekst er ofte fraværende. Størrelsen på sella turcica hos de fleste pasienter med dvergvekst (70-75 %) er ikke endret, men sella beholder ofte den barnslige formen til en "stående oval", har en bred "juvenil" rygg, sinus i kilebenet henger etter når det gjelder pneumatisering. Imidlertid finnes det pasienter med en forstørret sella turcica, som er et tegn på en svulst; med områder med forkalkning på bakgrunnen eller i området ved inngangen (ved kraniofaryngeom, gjenværende effekter av nevroinfeksjon) eller reduksjon av den (tegn på underutvikling, liten størrelse på hypofysen). Symptomer på intrakraniell hypertensjon observeres: tynning av kraniehvelvbeinene, økt vaskulært mønster, tilstedeværelse av fingeravtrykk, etc. Det viktigste tegnet på hypofysedvergvekst er en forsinkelse i tidspunktet for differensiering og ossifikasjon av skjelettet. Funksjoner ved tannsystemet er også nært knyttet til skjelettdifferensiering: sen utskifting av melketenner er observert. Den største forsinkelsen i utviklingen av skjelettsystemet observeres hos pasienter med dvergvekst med seksuell insuffisiens og hypotyreose.
Kjønnsorganene til de fleste pasientene er alvorlig underutviklede, selv om misdannelser er sjeldne. Vi observerte kryptorkisme hos 5,8 % av mannlige pasienter. Seksuell insuffisiens er ledsaget av underutvikling av sekundære seksuelle karakteristika og redusert seksuell lyst, fravær av menstruasjon. Normal spontan seksuell utvikling observeres kun hos pasienter med isolert veksthormonmangel og hos noen pasienter med cerebral dvergvekst.
Skjoldbruskkjertelinsuffisiens er et ganske vanlig symptom på dvergvekst. Det bør bemerkes at de ytre manifestasjonene av hypotyreose ikke alltid gjenspeiler den sanne funksjonelle tilstanden til skjoldbruskkjertelen. Dette skyldes relativ hypotyreose på grunn av et brudd på overgangen av tyroksin (T4 ) til trijodtyronin (T3 ) og dannelsen av inaktiv (reversibel) T3 , som er karakteristisk for somatotropisk insuffisiens.
Adrenokortikotropisk funksjon ved hypofysedvergvekst avtar sjeldnere og i mindre grad enn kjønns- og skjoldbruskstimulerende funksjoner, og hos de fleste pasienter krever den ikke spesiell korreksjon.
I de fleste tilfeller er ikke intellektet svekket. Emosjonelle endringer i form av mental infantilisme observeres; hos eldre pasienter uten intellektuell svekkelse observeres noen ganger reaktive nevroser.
Ved organisk cerebral patologi, spesielt av svulstkarakter, kan dvergvekst oppstå med symptomer på diabetes insipidus, bitemporal hemianopsi og intellektuelle funksjonshemminger.
Studien av utviklingen av bioelektrisk aktivitet i hjernen hos pasienter uten organiske symptomer på sentralnervesystemet viste at deres EEG er preget av umodenhet, langvarig bevaring av høy "barnslig" EEG-spenning; ujevnheter i alfarytmen i amplitude og frekvens; en kraftig økning i innholdet av langsomme θ- og δ-rytmer, spesielt i frontale og sentrale ledninger; en tydelig reaksjon på hyperventilering; et skifte i EEG-rytmeområdet som følger rytmene av lysstimulering mot lave frekvenser (bevis på en reduksjon i funksjonell mobilitet i hjernens nervestrukturer). Det ble avslørt at hos eldre pasienter skyldes den umodne naturen til hjernens elektriske aktivitet seksuell underutvikling, og hos pasienter i alle aldersgrupper - hypotyreose.
Karbohydratmetabolismen hos pasienter med dvergvekst er preget av en tendens til å synke fastende blodsukkernivåer, en økning under fysisk anstrengelse, utilstrekkelig endogent insulin, økt følsomhet for eksogent insulin med hyppig utvikling av hypoglykemiske tilstander. Sistnevnte forklares hovedsakelig av utilstrekkelige nivåer av kontrainsulære hormoner i pasientenes kropp.
Indre organer viser splanchnomykri, dvs. en reduksjon i størrelse. Ingen funksjonelle endringer i indre organer spesifikke for dvergvekst er beskrevet. Arteriell hypotensjon med redusert systolisk og diastolisk trykk og redusert pulsamplitude observeres ofte. Hjertelyder er dempet, funksjonelle bilyder av forskjellige emner høres på grunn av trofiske endringer i myokardiet og autonome lidelser. EKG er preget av lav spenning (spesielt ved hypotyreose), sinusbradykardi eller bradyarytmi; PCG viser en reduksjon i toneamplitude, tilleggstoner og funksjonelle bilyder. Oksygemometridata indikerer hypoksemi (initial og under fysisk anstrengelse) og oksygengjeld. Eldre pasienter utvikler noen ganger hypertensjon.
Diagnostikk dvergvekst
Diagnosen og differensialdiagnosen av dvergvekst er basert på anamnesedata og en omfattende klinisk, radiologisk, laboratorie- og hormonell undersøkelse. I tillegg til absolutt kroppsstørrelse bestemmes vekstunderskudd – forskjellen mellom pasientens høyde og gjennomsnittsnorm for tilsvarende kjønn og alder – for å vurdere pasientens vekst; vekstalder – samsvar med pasientens høyde med visse standarder; indikator på normalisert avvik
I = M - Mcp / δ, hvor M er pasientens høyde, Mcp er den gjennomsnittlige normale høyden for et gitt kjønn og alder, δ er kvadratavviket fra Mcp; I mindre enn 3 er typisk for nanisme, I mer enn 3 er typisk for gigantisme. Denne indikatoren kan brukes til å vurdere utviklingsdynamikken.
Røntgenundersøkelse av pasienter med dvergvekst avslører tegn på intrakraniell hypertensjon, resteffekter av nevroinfeksjon, forkalkninger og kraniosynostose. Studiet av størrelsen, formen og strukturen til sella turcica regnes som en indirekte indikator som karakteriserer størrelsen på hypofysen. En av de viktigste manifestasjonene av patologisk vekstretardasjon er et brudd på skjelettdifferensiering. For å vurdere graden av skjelettmodenhet bestemmes beinalder (radiografisk), som tilsvarer benvevsdifferensiering; ossifikasjonsdefekt er graden av ossifikasjonsavvik fra normen (i år), ossifikasjonskoeffisienten er kvotienten av å dele beinalder med kronologiske og andre parametere.
Moderne diagnostikk av dvergvekst er umulig uten å studere utskillelsen av somatotropisk hormon, dets basale nivå, døgnrytme og frigjøring under stimulering. De fleste pasienter med hypofysedvergvekst kjennetegnes av et redusert innhold av somatotropisk hormon i blodserumet. Når det bestemmes ved hjelp av radioimmunologisk metode, er det (ifølge forskjellige forfattere) fra (0,87 ± 0,09) til (1,50 ± 0,64) ng/ml, med en gjennomsnittlig norm på (3,81 ± 0,29) ng/ml. En studie av daglige (døgn)rytmer av somatotropisk hormonsekresjon viste at nivået hos friske mennesker er maksimalt i løpet av de første 2 timene med søvn og klokken 4-6 om morgenen. Ved dvergvekst er innholdet av somatotropisk hormon også redusert i løpet av disse timene.
For å studere reservene til den somatotropiske funksjonen brukes forskjellige stimulanter, der innholdet av somatotropisk hormon undersøkes før og etter introduksjonen. Blodprøver til studien tas hvert 30. minutt i 2-3 timer. Frigjøring av somatotropisk hormon etter stimulering anses som normal, minst opptil 7-10 ng/ml, noen ganger når den 20-40 ng/ml. Hvis det ikke er noen reaksjon i en av prøvene, utføres gjentatte tester med andre stimulanter. Utilstrekkelighet av somatotropisk hormon anses som bevist i fravær av frigjøring av somatotropisk hormon i 2-3 forskjellige prøver.
De mest brukte stimulerende testene er: med intravenøs administrering av 0,1 U (0,75–1,5 U) insulin per 1 kg av pasientens kroppsvekt og oppnåelse av hypoglykemi (en reduksjon i blodsukkernivået på 50 % sammenlignet med startnivået), bestemmes serum-somatotropisk hormon i henhold til skjemaet ovenfor. Hvis alvorlig hypoglykemi utvikler seg, avbrytes testen, og pasienten får glukose intravenøst. Dette er den vanligste, klassiske diagnostiske metoden.
TRH i en dose på 200–500 mcg intravenøst. Identifiserer effektivt hormonreserver og forårsaker ikke komplikasjoner. I kombinasjon med insulintesten kan man bedømme nivået av skade på hypothalamus-hypofysesystemet. En positiv reaksjon på TRH i fravær av insulin eller hypoglykemi indikerer intakt hypofyse og skade på hypothalamusnivå, negative reaksjoner på TRH og hypoglykemi indikerer skade på selve hypofysen.
TRH, LH-RH i en dose på 300 mcg intravenøst er lik den forrige.
Humant SGH er en syntetisk analog av en biologisk aktiv forbindelse isolert fra en bukspyttkjertelsvulst. For tiden finnes det 3 typer syntetisk SGH: med 29, 40 og 44 aminosyrerester. Det brukes intravenøst i doser fra 1 til 3 μg/kg av pasientens kroppsvekt. Frigjøring av STH observeres 15–20 minutter etter administrering, og testen er mer effektiv enn andre for å avdekke reserver av endogent veksthormon. En positiv SGH-reaksjon indikerer et hypothalamisk nivå av skade på den somatotropiske funksjonen og en intakt hypofyse; med aminosyrer (L-argininmonoklorid, ornitin, tryptofan, glysin, leucin) intravenøst i en dose på 0,25–0,5 g per 1 kg av pasientens kroppsvekt. Effektiv for å studere SGH-reserver. Kan forårsake allergiske reaksjoner.
L-dopa oralt i en dose på 250–500 mcg. Effektiv, godt tolerert av pasienter.
Tester med glukagon, bromergokryptin (parlodel), lysinvasopressin, klonidin og dosert sykkelergometrisk belastning brukes også.
Studien av tilstanden til den somatotropiske funksjonen er nødvendig ikke bare for diagnose av dvergvekst, men også for det begrunnede valget av en behandlingsmetode, siden behandling med somatotropin bare er rasjonell i tilfelle utilstrekkelig endogent veksthormon.
For å stille diagnosen dvergvekstform er det svært viktig å studere innholdet av insulinlignende vekstfaktorer, eller somatomediner (spesielt IGF-1 eller somatomedin C) – mediatorer av virkningen av somatotropisk hormon på vevsnivå. Det er kjent at innholdet av somatomedin C ved dvergvekst er redusert, og ved akromegali – økt sammenlignet med normen. Dvergvekstformen beskrevet av Laron er en type sykdom med normal produksjon av STH, men med et brudd på dannelsen av IGF-1 og IGF-II. Behandling av slike pasienter med somatotropin er nytteløs.
Indirekte indikatorer på hypofysens somatotrope funksjon er aktiviteten til alkalisk fosfatase og innholdet av uorganisk fosfor i serum. Ved hyposomatotrope tilstander er disse indikatorene reduserte. Ved panhypopituitær form for dvergvekst reduseres utskillelsen av gonadotropiner, ofte TSH, noe som er ledsaget av en tilsvarende reduksjon i funksjonene til kjønnskjertlene (mangel på androgener eller østrogener), skjoldbruskkjertelen (reduksjon i nivåene av T3 , T4 , proteinbundet jod - PBI, akkumulering av 131I i skjoldbruskkjertelen) og binyrene (reduksjon i mengden kortisol og 17-OCS i plasma, utskillelse av 17-KC og 17-OCS i urinen, lymfocytose).
Alle typer hypofysisk (hypothalamus-hypofysisk) genetisk dvergvekst er preget av gjentatt sykdom hos barn i en familie med arv av autosomal recessiv (oftere) eller autosomal dominant type, veksthemming og fysisk utvikling fra 2-4 år med et etterslep på minst 2-3 grader fra gjennomsnittlige vekstnormer for et gitt kjønn, alder, populasjon, med lav spontan årlig vekstdynamikk, forsinket ossifikasjon. Ved et lavt nivå av somatotropisk hormon (i 2-3 stimulerende tester under 7 ng / ml) er terapi med somatotropisk hormon svært effektiv (gir en økning i høyde på minst 7 cm per år). Ved et normalt eller høyt nivå av somatotropisk hormon (med dets biologiske inaktivitet) kan følsomheten for hormonet opprettholdes. Ingen endringer i intelligens observeres.
Ved genetisk dvergvekst med vevsufølsomhet for somatotropisk hormon, er det kliniske bildet likt isolert veksthormonmangel, men somatotropinbehandling er ineffektiv. I denne gruppen kan følgende hovedformer skilles ut i henhold til IRF-nivå: med normalt innhold (IRF-reseptordefekt) og redusert - Laron-type dvergvekst (IRF-1- og IRF-II-mangel) og typen som finnes hos afrikanske pygméer (IRF-1-mangel).
Cerebral dvergvekst er preget av isolerte sykdommer i en familie assosiert med intrauterin eller postnatal skade på sentralnervesystemet, med tilstedeværelse av åpenbare organiske forandringer i sentralnervesystemet, ofte kombinert med patologi i synsorganet, tilstedeværelse av diabetes insipidus, bevaring av gonadotrope funksjoner og endringer i intelligens.
Noen typer gonadal dysgenese og agenese er ledsaget av markert kort vekst, spesielt Shereshevsky-Turners syndrom og den "Turneroid" (mosaikk) formen av testikulær dysgenesesyndrom. Cytogenetiske studier (kjønnskromatin, karyotype) bidrar til differensialdiagnose, og avdekker kromosomale defekter, samt karakteristiske defekter i somatisk og seksuell utvikling, normale eller forhøyede nivåer av endogent somatotropisk hormon og ufølsomhet for behandling med somatotropin.
Blant endokrine lidelser som oppstår ved kort vekst, bør primær hypotyreose fremheves, forårsaket av medfødt hypoplasi eller aplasi i skjoldbruskkjertelen, dens dystopi, enzymatiske defekter i biosyntesen av skjoldbruskkjertelhormoner, tidlig autoimmun skade på skjoldbruskkjertelen. Ved alle disse tilstandene dominerer tegn på hypotyreose med et høyt nivå av TSH, en reduksjon i T4 og T3 i blodserum . Ved myxedem av autoimmun opprinnelse oppdages antistoffer mot tyreoglobulin, mikrosomale og nukleære fraksjoner av skjoldbruskvev i blodet, nivået av somatotropisk hormon er normalt eller redusert. Den kliniske effekten kan oppnås ved kun å kompensere for hypotyreose.
Kortvoksthet er ledsaget av for tidlig seksuell utvikling og adrenogenitalt syndrom på grunn av tidlig lukking av vekstsoner; Itsenko-Cushings sykdom, som oppstår i barndommen på grunn av den hemmende effekten av glukokortikoider på utskillelsen av somatotropisk hormon og deres katabolske effekt; Mauriac syndrom - kortvoksthet og infantilisme hos pasienter med alvorlig insulinavhengig diabetes mellitus.
Hypofysdvergvekst bør differensieres fra somatogen forsinkelse i fysisk utvikling forårsaket av kroniske metabolske forstyrrelser (ved sykdommer i lever, nyrer, mage-tarmkanalen), kronisk hypoksi (ved sykdommer i hjerte- og karsystemet og luftveiene, ved anemi); ved systemiske sykdommer i muskel- og skjelettsystemet (kondrodystrofi, ufullkommen osteogenese, eksostosesykdom), etc.
Funksjonell (konstitusjonell) veksthemming observeres noen ganger ved sen pubertets debut hos tilsynelatende friske ungdommer; vi har funnet at det primært er assosiert med forbigående insuffisiens av gonadotropisk aktivitet. Utskillelsen av somatotropisk hormon er vanligvis ikke svekket eller er noe redusert. Stimulering av gonadotropiner kan akselerere både seksuell utvikling og vekst.
Kortvoksthet av familiær art bør betraktes som en variant av fysiologisk utvikling.
Hva trenger å undersøke?
Hvordan undersøke?
Hvilke tester er nødvendig?
Hvem skal kontakte?
Behandling dvergvekst
Behandling av dvergvekst er en lang prosess. Dette tvinger legen til å fordele virkemidlene for å påvirke veksten over tid for å oppnå størst mulig klinisk effekt samtidig som man overholder to grunnleggende prinsipper:
- maksimal tilnærming av behandlingsindusert utvikling til fysiologiske forhold;
- skåner de epifysære vekstsonene.
Mange års erfaring med behandling av dvergvekst gjør at vi kan anse følgende skjema for trinnvis behandling som passende. Diagnosen dvergvekst hos voksne pasienter gir vanligvis ingen tvil. Hos små barn, hvis det kliniske bildet er uklart, er en diagnostisk periode nødvendig: 6–12 måneder under observasjon uten hormonbehandling. I løpet av denne tiden foreskrives kompleks generell styrkende behandling; tilstrekkelig ernæring med økning i innholdet av animalsk protein, grønnsaker og frukt i kosten, vitamin A og D, kalsium- og fosforpreparater. Fravær av tilstrekkelige endringer i vekst og fysisk utvikling på denne bakgrunnen og påvisning av endokrine forstyrrelser under undersøkelse er grunnlaget for å starte hormonbehandling.
Den viktigste typen patogenetisk terapi for hypofysedvergvekst er bruk av humant veksthormon, siden forekomsten av de fleste tilfeller av dvergvekst utvilsomt er avhengig av en eller annen form for mangel. På grunn av artsspesifisiteten til dette hormonet, er det kun somatotropin fra mennesker og primater som er aktivt for mennesker. Et legemiddel isolert fra hypofysen til personer som døde av ikke-smittsomme og ikke-neoplastiske sykdommer er mye brukt i klinikken. Humant somatotropin utvinnes ved bakteriell syntese ved bruk av Escherichia coli ved genteknologi. Humant somatotropin syntetiseres også kjemisk, men det er ekstremt dyrt og brukes praktisk talt ikke i klinikken. Pasienter med påvist mangel på endogent veksthormon, med skjelettdifferensiering som ikke overstiger nivået som er typisk for 13-14 år, velges ut for somatotropinbehandling. Det er ingen aldersbegrensninger for behandling.
Minimum effektive doser som kan brukes i den første behandlingsperioden er 0,03–0,06 mg/kg kroppsvekt. De mest effektive dosene er 2–4 mg 3 ganger i uken. Økning av enkeltdosen til 10 mg ble ikke ledsaget av en tilstrekkelig økning i veksteffekten, men forårsaket rask dannelse av antistoffer mot somatotropin.
I vårt land har det blitt arbeidet med å studere humant veksthormon siden 1960. To behandlingsregimer har blitt testet: kontinuerlig og intermitterende med kurer på 2–3 måneder og samme intervaller mellom dem. Den gjennomsnittlige økningen i høyde hos pasienter i løpet av det første behandlingsåret var 9,52 ± 0,39 cm, økningen i kroppsvekt var 4,4 ± 0,14 kg. Ved langvarig kontinuerlig behandling var den gjennomsnittlige økningen i høyde 0,82 cm/måned, kroppsvekt - 0,38 kg/måned; ved intermitterende - henholdsvis 0,75 cm/måned og 0,4 kg/måned. Kontinuerlig behandling ga en raskere økning i høyde med en kraftig reduksjon i effekten etter 1–1,5 år, ved intermitterende behandling ble effektiviteten opprettholdt i 3–4 år, noe som gjør at vi kan anse behandlingsregimet som mer passende. Bestemmelse av nivået av IGF-I (somatomedin C) kan tjene som en pålitelig indikator på pasientens følsomhet for behandling med somatotropinlegemidler. En økning i IGF-I-innholdet etter introduksjon av somatotropisk hormon lar en forutsi en positiv effekt av terapien. En viktig fordel med somatotropinbehandling er fraværet av akselerasjon av skjelettforbening mot denne bakgrunnen.
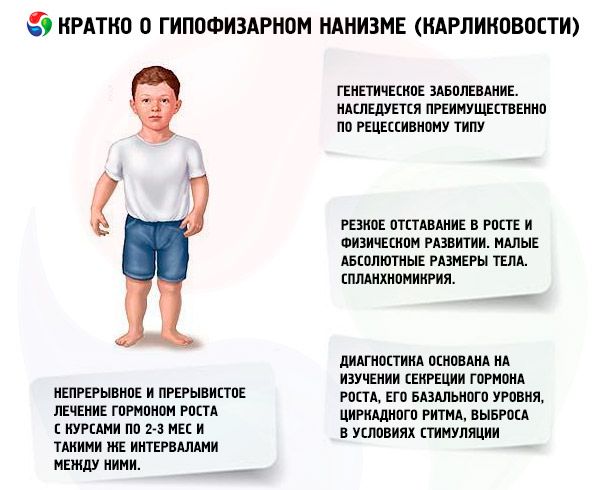
Det viktigste middelet for behandling av dvergvekst er bruk av anabole steroider, som stimulerer vekst ved å øke proteinsyntesen og øke nivået av endogent somatotropisk hormon. Behandlingen utføres over flere år, med gradvis erstatning av noen legemidler med andre, fra mindre aktive til mer aktive forbindelser. En endring av anabole legemidler er indikert når veksteffekten avtar etter 2-3 år, noe som fører til en ytterligere økning i vekst. Behandlingen utføres i kurer (hvileperioden bør være halvparten av behandlingsperioden). Ved avhengighet er lengre pauser også indikert (opptil 4-6 måneder). Kun ett av de anabole steroidene foreskrives om gangen. Å kombinere 2 eller flere legemidler er upassende, da dette ikke forsterker deres metabolske og veksteffekter. Sistnevnte avhenger først og fremst av pasientenes alder og graden av differensiering av skjelettknoklene ved behandlingsstart. Den beste effekten observeres hos pasienter under 16-18 år med skjelettforbening som ikke overstiger nivået som er karakteristisk for en 14-åring. Det anbefales å starte behandlingen umiddelbart etter diagnose, vanligvis fra 5-7 år. Før behandling er det nødvendig å unngå å foreskrive gonadotropiner og kjønnshormoner, som samtidig stimulerer vekst, men samtidig akselererer skjelettdifferensiering. Prinsippet for dosering av anabole steroider er fra minimale effektive doser til gradvis økende doser. De anbefalte dosene av de vanligste legemidlene: nerobol (metandrostenol, dianabol) - 0,1-0,15 mg per 1 kg kroppsvekt per dag oralt; nerobolil (durabolin) - 1 mg per 1 kg kroppsvekt per måned intramuskulært, den månedlige dosen administreres i henholdsvis 2-3 doser etter 15 eller 10 dager; retabolil (deca-durabolin) - 1 mg per 1 kg kroppsvekt én gang i måneden intramuskulært. Overskridelse av de angitte dosene kan føre til androgenisering. I fysiologiske doser påvirker ikke disse forbindelsene tilstanden til kjønnsorganene og differensieringen av skjelettben betydelig, noe som gjør at de kan brukes over lengre tid hos pasienter av begge kjønn. Jenter bør være under oppsyn av en gynekolog, da noen pasienter ved overdose eller økt individuell følsomhet kan utvikle tegn på virilisering, som raskt går tilbake når behandlingen avsluttes. Orale legemidler metylert til etylert i 17. posisjon kan noen ganger forårsake en kolestatisk effekt. Derfor bør man ved leversykdommer foretrekke parenterale anabole forbindelser, eller orale legemidler bør kombineres med koleretiske midler. Svært sjelden kan behandling med anabole steroider forårsake allergiske reaksjoner (kløe, utslett). I fravær av komplikasjoner brukes anabole steroider så lenge veksteffekten observeres (opptil 16-18 år, og noen ganger lenger). Behandlingen utføres mot bakgrunn av generell styrkende terapi.
Hvis pasienter har tegn på hypotyreose, foreskrives skjoldbruskkjertelmedisiner (tyroksin, tyreoidin, tyrotom) samtidig i individuelt valgte doser.
Ved behandling av gutter er neste trinn administrering av humant koriongonadotropin. Dette legemidlet brukes tidligst 15–16 år, og ofte enda senere for å stimulere Leydig-celler, noe som akselererer både seksuell utvikling og vekst (på grunn av den anabole aktiviteten til deres egne androgener). Doser på 1000 til 1500 IE brukes 1–2 ganger i uken intramuskulært i 2-måneders kurer, ikke mer enn 2–3 ganger i året. Hvis effekten er ufullstendig, veksles behandling med humant koriongonadotropin hos gutter fra 16 år og eldre med administrering av små doser androgener (metyltestosteron i en dose på 5–10 mg/dag sublingualt).
Jenter over 16 år kan starte behandling med små doser østrogen, som simulerer en normal seksuell syklus. Behandlingen utføres i 3 uker hver måned, etterfulgt av en pause. I den andre fasen av syklusen, fra den tredje uken, kan koriongonadotropin foreskrives i en dose på 1000-1500 IE 3-5 ganger i uken eller legemidler med gestagen effekt (pregnin, progesteron).
Den siste fasen av behandlingen (etter lukking av vekstsoner) er konstant administrering av terapeutiske doser kjønnshormoner som tilsvarer pasientens kjønn, for å fullt utvikle kjønnsorganene, sekundære seksuelle egenskaper, sikre libido og seksuell potens. Kombinerte østrogen-progestogenpreparater (non-ovlon, bisecurin, infekundin, rigevidon) er praktiske for behandling av kvinnelige pasienter, og androgenpreparater med forlenget frigivelse (testenat, sustanon-250, omnadren-250) er praktiske for behandling av mannlige pasienter.
Generell styrkende behandling utføres (regime, protein-grønnsakskosthold, vitaminbehandling, biostimulanter). Bruk av sinkpreparater er indikert, hvis virkningsmekanisme hovedrollen spilles av å øke aktiviteten til IGF-1 (insulinlignende vekstfaktor I).
Ved organisk patologi fra sentralnervesystemet administreres antiinflammatorisk, resorptiv og dehydreringsbehandling. Målrettet systematisk behandling gir en oppmuntrende effekt. Som et resultat av langvarig trinnvis behandling klarte 148 (80,4 %) av 175 pasienter med dvergvekst av begge kjønn å oppnå en høyde på over 130 cm, 92 (52,5 %) - over 140 cm, og 32 (18,3 %) - 150–160 cm eller mer. Samtidig økte 37 pasienter (21,2 %) høyden med 30 cm, 107 (61,1 %) med 31–50 cm, og 31 (17,7 %) med 51–60 cm eller mer.
Prognose
Prognosen avhenger av formen for dvergvekst. Ved genetiske typer dvergvekst er livsprognosen gunstig. Ved hypofysetumor og organisk skade på sentralnervesystemet bestemmes den av dynamikken i utviklingen av den viktigste patologiske prosessen. Moderne behandlingsmetoder har økt pasientenes fysiske evner og arbeidskapasitet betydelig, og forlenget deres forventede levealder. I løpet av aktiv behandlingsperiode må pasientene undersøkes av lege hver 2.-3. måned, med vedlikeholdsbehandling - hver 6.-12. måned.
Sysselsetting av pasienter som samsvarer med deres intellektuelle og fysiske evner er av største betydning for deres sosiale tilpasning.
Det er lurt å velge yrker som ikke er forbundet med tung fysisk anstrengelse, men som lar deg demonstrere intellektuelle evner, evnen til å utføre presist arbeid og språkkunnskaper.


 [
[