Medisinsk ekspert av artikkelen
Nye publikasjoner
Medisiner
Legemidler som forebygger trombose og forbedrer blodets reologi
Sist anmeldt: 07.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
For å forebygge dannelsen av flere mikrotromber under sjokk og deres ødeleggelse, kan ulike farmakologiske tilnærminger brukes som bruker legemidler som forhindrer trombedannelse og forbedrer blodreologien:
- eliminering av systemiske hemodynamiske og mikrosirkulasjonsforstyrrelser ved bruk av vasoaktive og inotrope midler;
- tiltak for å forbedre blodreologi ved bruk av rasjonell infusjonsbehandling og legemidler som gjenoppretter elastisiteten til erytrocytmembraner (trental eller pentoksifyllin);
- forebygging av blodplateaggregering og dannelse av initiale "hvite" tromber i små arterielle kar med påfølgende initiering av koagulasjonskaskaden;
- hemming av trombedannelse etter aktivering av den systemiske koagulasjonskaskaden;
- aktivering av fibrinolyse med sikte på å løse opp nydannede blodpropper (fibrinolysin, streptokinase, streptodekase, urokinase, etc.) eller tvert imot hemming av fibrinolyse når den generaliseres hos noen pasienter med traumatisk sjokk og sepsis (aminokapronsyre, amben, contracal, etc.).
De fleste av de listede tilnærmingene er tradisjonelle, velutviklede i praksisen med behandling av sjokk, har sine egne hemorheologiske indikasjoner og er spesifisert i de relevante kapitlene. Derfor er det i denne delen tilrådelig å dvele ved vurderingen av den generelle tilnærmingen til forebygging av trombedannelse i sjokk ved bruk av farmakologiske midler som påvirker profasen av blodkoagulasjon. Det er dette nivået av forebygging av koagulasjonskomplikasjoner - forekomst, dannelse og vekst av "hvite arterielle tromber" - som tiltrekker seg forskernes største oppmerksomhet.
Ulike og ofte multidireksjonelle forstyrrelser i blodkoagulasjon med forverring av reologien er karakteristiske for ulike typer sjokk. Det mest karakteristiske for septiske, endotoksin-, brannskade-, traumatiske og hemoragiske sjokktyper er dannelsen av flere mikrotromber i de minste karene, forårsaket av forstyrrelser i systemisk hemodynamikk, vasospasme og mikrosirkulasjonsforstyrrelser, blodfortykning, slamdannelse, redusert elastisitet i erytrocyttmembraner, samt en rekke generelle og lokale faktorer (autokoider) som initierer lokale endringer i koagulasjonshemostasen og inkludering av profase for blodkoagulasjon.
I en skjematisk (forkortet) form presenteres den innledende fasen av hemokoagulasjon og mekanismen for lokal hemokoagulasjonshomeostase som følger.
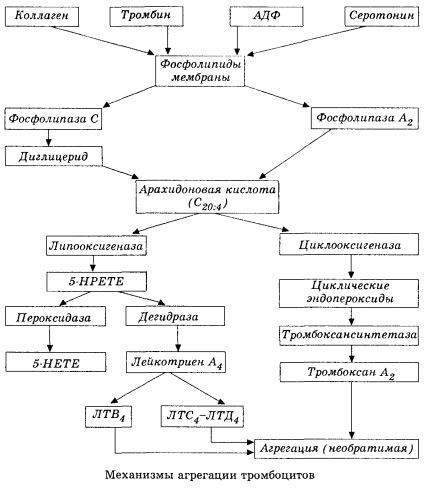
Det begynner med aktivering av membranfosfolipase A2 som et resultat av påvirkningen av en kombinasjon av skadelige faktorer (direkte membranskade, hypoksi, lipidperoksidasjon, påvirkning av endogene kjemiske faktorer, etc.). Som et resultat av nedbrytningen av membranfosfolipider frigjøres ikke-esterifiserte langkjedede fettsyrer, hvorav arakidonsyre er det viktigste som et initialt substrat. Transformasjonen av dette (arachidonsyrekaskade) skjer via lipoksygenase (syntese av leukotriener) og cyklooksygenase (syntese av prostaglandiner, tromboksaner, prostacyklin)-veiene.
De resulterende leukotrienene (B4, C4, E4, D4, etc.) – stoffer med ekstremt høy biologisk aktivitet, som inkluderer det sakte reagerende stoffet fra anafylaksi – er av stor betydning for initieringen av lokale vaskulære, inflammatoriske og immunreaksjoner, inkludert autoimmune prosesser. Leukotriener forårsaker mikrosirkulasjonsforstyrrelser, økt blodkoagulasjon, frigjøring av autolytiske lysosomale enzymer og frigjøring i blodet av en faktor som hemmer myokardiell kontraktilitet og bronkial spasme.
På grunn av deres evne til å forårsake glatt muskulaturkontraksjon, påvirker leukotriener betydelig systemisk hemodynamikk, koronarkar og myokard, og utøver en kraftig koronarkonstriktor og negativ inotrop effekt, som er ledsaget av en reduksjon i hjerteminuttvolum og spiller en viktig rolle i utviklingen av hypotensjon.
Redusert hjerteminuttvolum og hypotensiv respons på leukotriener er assosiert med svekkelse av hjertemuskelen og begrensning av venøs retur til hjertet. Av betydelig betydning for å begrense venøs retur er leukotrieners evne til å øke permeabiliteten til karveggen og forårsake plasmaekstravasasjon. Leukotriener anses å være viktige i patogenesen til hjerteinfarkt.
Ved anafylaktisk og septisk (endotoksin) sjokk øker deres rolle tilsynelatende enda mer, noe som fremgår av leukotrieners evne til å akkumulere seg i betydelige mengder i plasma under allergiske reaksjoner og forårsake endringer i systemisk blodstrøm som er karakteristisk for anafylaktisk sjokk, samt de beskyttende effektene av leukotrienreseptorblokkere og lipoksygenasehemmere. Utviklingen av selektive leukotrienreseptorblokkere pågår ganske intensivt og er en lovende vitenskapelig retning. På dette området er det allerede oppnådd en viss suksess, og effektiviteten til slike blokkere ved myokardiskemi, endotoksin og hemoragisk sjokk er eksperimentelt bekreftet. Det vil imidlertid sannsynligvis ta flere år før denne retningen implementeres klinisk.
Hvis tromber dannes i venøse kar med lik deltakelse av trombocytter og plasmakoagulasjonsfaktorer, er trombocytter de viktigste initiatorene for prosessen i arteriene. De inneholder ADP, Ca2+, serotonin, fosfolipider, enzymer av prostaglandin- og tromboksansyntese, trombostenin (som muskelaktomyosin gir disse cellenes kontraktile evne), trombogen vekstfaktor i epitel- og muskelceller i karveggen og en rekke andre stoffer. Humoral regulering av trombocyttfunksjoner utføres gjennom spesialiserte reseptorer i membranene deres (alfa2- og beta2-adrenoreseptorer, reseptorer for histamin og serotonin, acetylkolin, tromboksan, adenosin og en rekke andre). En spesiell egenskap ved trombocytter er en høy affinitet for kollagen og andre subendoteliale elementer i karveggen, for ikke-fuktende og negativt ladede overflater. Denne egenskapen gir trombocytter en eksepsjonell evne til å feste seg til en del av et kar med skadet endotel, som har god mulighet til å bli skadet under sjokk. I dette tilfellet sprer trombocyttene seg ut og frigjør pseudopodier, som kan feste seg til hverandre og til karveggen. Membranpermeabiliteten øker, og ADP, serotonin, tromboksan og noen koagulasjonsfaktorer adsorbert på overflaten av trombocytten frigjøres fra trombocyttene. Disse stoffene samhandler med de tilsvarende reseptorene på membranen og forårsaker, med deltakelse av kalsiumioner, aggregering (initialt reversibel). Prosessen blir selvopprettholdende, noe som forenkles av humorale regulatoriske faktorer; andre faktorer kan derimot stoppe den og til og med reversere den, noe som forårsaker disaggregering.
Med overvekt av trombedannende påvirkninger og forhold erstattes adhesjons- og reversible aggregeringsfaser av den tredje fasen - irreversibel aggregering, som utføres med deltakelse av trombostenin og fører til innsnevring av koagulasjonen; reaksjonen med styrking av aggregatet og innsnevring skjer også med deltakelse av Ca+, ATP og fører til dannelsen av en hvit trombe.
Syklooksygenaseveien for arakidonsyreomdannelse i blodplater, vaskulære endotelceller og annet vev sikrer lokal (halveringstiden for metabolitter er svært kort) koagulasjonshomeostase, siden kraftige pro- og antiaggregerende stoffer dannes under denne metabolismen. Hovedfaktoren som aktiverer blodplateaggregering i cyklooksygenasekjeden av reaksjoner er tromboksan A2, og dens ikke mindre kraftige antagonist er prostacyklin, produsert av endotelceller, og i mindre grad prostaglandiner i E- og G-serien. Til slutt påvirkes blodplateaggregering sterkt av ytterligere lokale og systemiske humorale faktorer.
Blodplateaggregeringsaktivatorer og -hemmere
Initiatorer og aktivatorer av blodplateaggregering |
Blodplateaggregeringshemmere |
Kollagen |
- |
ADP |
Adenosin og dets stabilisatorer |
Noradrenalin (via alfa2-reseptorer) |
Alfa-adrenerge blokkeringsmidler |
Serotonin |
Antiserotoninmidler |
Histamin |
Antihistaminer |
Trombin |
Heparin |
Ca2+ |
Ca2+-antagonister |
CGMP - dens indusere (acetylkolin?) og stabilisatorer |
CAM - dens indusere (via beta-adrenerge reseptorer) og stabilisatorer (fosfodiesterasehemmere) |
Arakidonsyre |
Dekstraner, albumin |
Tromboksan A2 |
Prostacyklin I2 |
Farmakologiske inngrep i den innledende fasen av trombedannelse ved sjokk og akutte iskemiske prosesser i hjertet og hjernen antyder følgende mulighet:
- hemming av initiale reaksjoner (total og delvis) av arakidonsyrekaskaden;
- hemming av en bestemt reaksjon av tromboksansyntese;
- blokade av reseptorer for leukotriener og tromboksaner i blodplater, glatt muskulatur og andre celler;
- bruk av stoffer som modulerer blodplateaggregering, dvs. svekker på andre måter sistnevntes reaksjon på påvirkning av initierende faktorer (kollagen, tromboksan A2, leukotriener, etc.).
Implementeringen av de listede metodene for korrigering av forstyrrelser i blodets reologiske egenskaper gir løsning på den viktigste taktiske oppgaven: å beskytte reseptorer for aggregering og adhesjon av blodplater mot effekten av aktivatorer eller å undertrykke intracellulære syntesemekanismer for disse reseptorene. Hemming av de første reaksjonene i arakidonsyrekaskaden kan oppnås ved å beskytte blodplatereseptorer som reagerer på polymeraktivatorer, ved bruk av lavmolekylære dekstraner, hvis molekyler konkurrerer med fibrin, kollagen, aggregert immunoglobulin (IgE) og komponenter i komplementsystemet.
Ved å maskere reseptorene på blodplatemembranen og konkurrere med store, spredte proteiner på overflaten av erytrocytter, fortrenger lavmolekylære dekstraner dem og ødelegger broene mellom cellene. Dette skyldes det faktum at dekstraner, som omslutter det vaskulære endotelet og overflaten av blodcelleelementer, øker sin negative ladning, og dermed forbedrer antiaggregeringsegenskapene.
Dextraner
Lavmolekylære dekstraner reduserer kollagen- og ADP-indusert blodplateaggregering, samt den aktiverende effekten av trombin på blodplater, hemmer veksten av den initiale hvite blodplatetromben, forbedrer blodstrømmen, reduserer den postoperative økningen i plasmafibrinogeninnhold og endrer strukturen og stabiliteten til fibrin.
Intravenøse infusjoner av dekstraner ved traumer og sjokk reduserer ikke bare blodplateaggregering og adhesjon, men mobiliserer også endogent heparin, og fremmer dermed dannelsen av en løs og vanskelig tilbaketrekkbar blodpropp, som lett lyseres av fibrinolytika. Antitrombinaktiviteten til lavmolekylære dekstraner er assosiert med deres spesifikke effekt på strukturen og funksjonen til blodkoagulasjonsfaktor VIII. Faktor VIII (antihemofil globulin), et stort molekyl med en kompleks struktur og funksjon, er involvert i blodplateaggregering og stabiliteten til den resulterende koagulen. Dekstraner forstyrrer virkningen av faktor VIII, og reduserer dermed blodplateaggregering og reduserer koagulasjonsstabilitet.
Lavmolekylære dekstraner er ikke ekte antikoagulantia, og deres korrigerende effekt ved hemorheologiske lidelser er hovedsakelig assosiert med hemodilusjon, påfylling av sirkulerende plasmavolum og forbedring av blodstrømmen i mikrosirkulasjonssystemet.
Dekstranenes evne til å forbedre blodstrømmen ved hemodynamiske lidelser (sjokk, blodtap) skyldes en rekke faktorer. Forekomsten av en høy, forbigående konsentrasjon av polymeren i blodet fører ikke bare til "direkte hemodilusjon", men skaper også betingelser for væskestrøm fra interstitiellrommet inn i blodet og den påfølgende balanseringen av den osmotiske effekten av dekstran. Som en konsekvens av hemodilusjon reduseres blodviskositeten, venøs tilstrømning til hjertet øker, og hjerteminuttvolum øker. Sammen med disse effektene danner dekstraner komplekser med fibrinogen og har en antilipemisk effekt.
Dermed bidrar den antiaggregerende virkningen og de hemodynamiske effektene av lavmolekylære dekstraner til å redusere blodets viskositet, noe som er spesielt viktig ved lave skjærhastigheter. Disaggregering av blodceller forbedrer systemisk blodstrøm og mikrosirkulasjon, spesielt i den venøse delen, hvor hastighetsgradientene er lavest. Bruk av lavmolekylære dekstranløsninger ved ulike typer sjokk, under kirurgisk behandling av skader og deres konsekvenser, og deretter i den postoperative perioden, bidrar til å forhindre hyperkoagulasjon og redusere sannsynligheten for trombotiske prosesser og emboli.
Det bør imidlertid bemerkes at infusjoner av dekstranløsninger i noen tilfeller er ledsaget av anafylaktiske og allergiske reaksjoner (farlige i nærvær av sensibilisering og anafylaktisk sjokk). Dette skyldes det faktum at dekstraner, som har en høy molekylvekt og mange sidekjeder, kan fungere som et antigen. For å fastslå individuell følsomhet anbefales det derfor å forhåndsadministrere intravenøst opptil 20 ml av en lavmolekylær dekstranløsning som en hapten (15 % løsning, molekylvekt 1000) og utføre infusjoner av en plasmaerstatning før innføring av anestesi.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombinhemmere
Farmakologisk beskyttelse av blodplatereseptorer som interagerer med blodplateaktivatorer kan også oppnås ved bruk av midler som konkurrerer med ikke-polymere blodplateaktivatorer eller hemmer dem. Slike midler inkluderer trombinhemmere (heparin og hirudin, en rekke syntetiske hemmere, adrenalinantagonister), alfa-reseptorblokkere (fentolamin, dihydroergotamin), ADP-antagonister (dipyridamol, adenosin og dets strukturelle analoger, fosfokreatin), serotoninantagonister (metysergid). Bare noen få av de listede midlene brukes faktisk til forebygging og behandling av sjokk av ulik opprinnelse.
Beskyttelse av intracellulære mekanismer for syntese av proteinreseptorer som reagerer med aktivatorer av blodplateaggregering og adhesjon, og hemming av tromboksansynteseprosesser er mulig med legemidler fra forskjellige grupper:
- indusere og stabilisatorer av cATP, prostacyklin og prostaglandin PgE2;
- fosfolipase- og fosfodiesterasehemmere.
Intensiv utvikling av spesielle blodplatehemmende midler startet relativt nylig og har ennå ikke ført til pålitelige resultater. For tiden, i klinisk praksis, i tillegg til dekstranløsninger, brukes slike blodplatehemmende midler som acetylsalisylsyre, indometacin, dipyradamol, sulfinpyrazon (persantin), prostacyklin (eikoprostenon) og heparin mye for å forhindre dannelsen av hvite blodplatetromber.
Ikke-steroide antiinflammatoriske legemidler
Det er fastslått at de farmakologiske effektene av ikke-steroide antiinflammatoriske legemidler - acetylsalisylsyre og indometacin - skyldes deres effekt på metabolismen av eikosanoider (tromboksaner og prostaglandiner). Nesten alle legemidler i denne gruppen hemmer enzymkomplekset kjent som prostaglandinsyntetase, og utøver dermed sine spesifikke og antiaggregerende effekter.
Acetylsalisylsyre absorberes svært raskt etter oral administrering. Produktet av hydrolysen, salisylsyre, forårsaker hemming av blodplate-cyklooksygenase, noe som forstyrrer omdannelsen av arakidonsyre til prostaglandin O2 og til slutt tromboksan A2. Acetylsalisylsyre hemmer aggregering indusert av kollagen, ADP, adrenalin og serotonin. Selv om GG05 er 15 minutter, varer den antiaggregerende effekten i flere dager, noe som tilsynelatende forklares med irreversibel hemming av prostaglandinsyntesereaksjoner og undertrykkelse av blodplateaggregeringsfunksjonen gjennom hele levetiden (6–10 dager). Sammen med hemming av blodplate-cyklooksygenase hemmer acetylsalisylsyre i høye doser cyklooksygenase i karveggen, og samtidig med undertrykkelse av tromboksan A2-syntese hemmer den prostacyklinsyntese i endotelceller. Derfor bør acetylsalisylsyre foreskrives som et antiaggregeringsmiddel i små doser (3000–5000 mg/dag), noe som hovedsakelig hemmer blodplateaggregering.
Siden acetylsalisylsyre blokkerer cyclooxygenase i blodplater i flere dager, og endotelial cyclooxygenase ikke mer enn én dag, er det rasjonelt å foreskrive legemidlet ikke daglig, men hver 3.-4. dag. Valget av optimal dose acetylsalisylsyre for pasienten bør gjøres individuelt, siden pasientene har ulik følsomhet for legemidlets antiplatelet effekt. Hos reaktive pasienter hemmer acetylsalisylsyre i en dose på 0,5 g blodplateaggregering med 40-50 %, hos hyperreaktive pasienter - fullstendig eller med 80-90 %, og for reaktive pasienter er fraværet av en antiplatelet effekt karakteristisk når man tar samme dose av legemidlet.
Selektive tromboksansyntetasehemmere er imidazol og dets analoger, som ikke blokkerer cyklooksygenase. Dipyridamol, som brukes i klinisk praksis i behandling av kronisk iskemisk hjertesykdom som en koronar dilatator, hemmer i likhet med imidazol selektivt tromboksansyntetase og forhindrer syntesen av tromboksan A2. Legemidlet og dets analoger antas også å hemme blodplatefosfodiesterase, og dermed øke konsentrasjonen av cAMP i blodplatene. Sammen med dette hemmer dipyridamol aktiviteten til adenosindeaminase og opptaket av adenosin av blodplatene, blokkerer absorpsjonen av serotonin av blodplatene og deres aggregering indusert av adrenalin og kollagen. Det er rapportert om svak blodplatehemmende aktivitet av legemidlet og dets evne i små doser til å forbedre blodplateaggregering. Den mest pålitelige blodplatehemmende effekten kan oppnås med en kombinasjon av dipyridamol og acetylsalisylsyre.
Heparin
Blant antitrombotiske midler er heparin en av de mest effektive regulatorene av blodets aggregerte tilstand, spesielt når det brukes tidlig. Heparin har en høy negativ ladning og er i stand til å samhandle med både store og små ioner og molekyler (enzymer, hormoner, biogene aminer, plasmaproteiner, etc.), slik at spekteret av dets biologiske virkning er ganske bredt. Legemidlet har antitrombin-, antitromboplastin- og antiprotrombin-effekter, forhindrer omdannelsen av fibrinogen til fibrin, undertrykker tilbaketrekning av blodpropp og øker fibrinolyse.
Mekanismen bak heparins antikoagulerende virkning er ganske kompleks. Det er nå fastslått at heparins antikoagulerende effekter er assosiert med potenseringen av antitrombin IIIs virkning og forbedringen av heparin-antitrombin III-kompleksets evne til raskt å inaktivere de fleste serinproteasene i blodkoagulasjonssystemet. I heparins antitrombotiske effekt er dets evne til å øke og opprettholde et høyt elektronegativt potensial i vaskulær intima, og dermed forhindre blodplateadhesjon og dannelse av blodplatemikrotromber, av stor betydning. Heparin undertrykker mest aktivt trombedannelse i vener, og forhindrer både lokal trombedannelse og disseminert intravaskulær koagulasjon.
Prostacyklin og dets stabile analoger
Blant platehemmende midler er prostacyklin og dets stabile analoger de kraftigste aggregeringshemmerne. Den platehemmende effekten av prostacyklin skyldes stimulering av adenylatcyklase og som en konsekvens en økning i konsentrasjonen av cAMP i blodplatene, en reduksjon i innholdet av tromboksan, en reduksjon i innholdet av tromboksan A2 og blokade av reseptorene. Prostacyklin er ustabilt og hydrolyseres raskt til inaktive produkter, så det administreres intravenøst ved drypp med en hastighet på 2 til 20 ng/kg per minutt i 30–60 minutter opptil 6 ganger daglig.
Prostacyklin har, sammen med en sterk antiaggregatorisk effekt, en kraftig vasodilatorisk og bronkodilatorisk effekt. Legemidlet utvider blodårene i hjernen, hjertet, nyrene, skjelettmuskulaturen og mesenteriske kar. Under påvirkning av prostacyklin øker koronar blodstrøm, energitilførselen til myokardiet øker og oksygenbehovet reduseres. Til tross for ustabiliteten i kroppen, kan klinisk gunstige effekter vare i flere uker og til og med måneder. Mekanismen for en slik langvarig virkning er ennå ikke klar.
Prostacyklin er et lavt toksisk legemiddel, men bruken kan forårsake bivirkninger: ansiktsrødme, hodepine, redusert blodtrykk, magesmerter, anoreksi. Sammen med prostacyklin er dets syntetiske stabile analoger (iloprost, etc.) lovende hemmere av blodplateaggregering.
Medisiner som forbedrer blodets viskositet
Forstyrrelser i blodets reologiske egenskaper under traumer og sjokk forårsakes ikke bare av endringer i blodplatenes funksjonelle aktivitet, men også av en økning i blodets viskositet. Blodets strukturelle viskositet som et komplekst dynamisk dispergert system bestemmes i stor grad av plasmaets viskositet og erytrocytters evne til å deformeres. Plasmaviskositeten avhenger hovedsakelig av konsentrasjonen av proteiner i blodet. Proteiner med lav molekylvekt, som albumin, har liten effekt på plasmaviskositeten, mens proteiner med et stort molekyl (fibrinogen, alfa- og gammaglobuliner, andre makromolekyler) øker den betydelig.
Ved lave skjærhastigheter fører adsorpsjon av fibrinogen og globuliner på overflaten av erytrocytter til dannelse av broer mellom tilstøtende celler og dannelse av aggregater fra erytrocytter. Dannelseshastigheten for aggregater er en kompleks biofysisk prosess og avhenger ikke bare av størrelsen på skjærkraften, men også av de elektrokinetiske egenskapene til erytrocytter, konsentrasjonen, massen og sorpsjonskapasiteten til makromolekylene som aggregerer, og av erytrocytters form og plastisitet.
Å opprettholde formen og de mekaniske egenskapene til erytrocyttmembranen krever betydelig energiforbruk. Det antas at energien som produseres i erytrocytter under glykolysen brukes på fosforylering av spektrin, noe som resulterer i endringer i proteinets sekundærstruktur og interaksjon med nærliggende komponenter i den indre membranen. Interaksjonen mellom membranens strukturelle proteiner, spektrin og aktin, spiller en viktig rolle i dannelsen av de mekaniske egenskapene til erytrocyttmembranen, for å opprettholde et konstant overflateareal av erytrocytten og dens tykkelse under enhver deformasjon.
Ved systemiske hemodynamiske og organbaserte blodstrømsforstyrrelser fører økningen i stivheten til erytrocyttmembranene og dannelsen av erytrocyttaggregater til en reduksjon i hastigheten på erytrocytters passasje gjennom kapillærene, og forstyrrer dermed blodets gasstransportfunksjon. Derfor bør korrigering av forstyrrelser i blodets reologiske egenskaper i sjokk, sammen med forebygging av erytrocyttaggregering, inkludere normalisering av plasma- og blodviskositet, aggregering og deformasjon av erytrocytter.
I tillegg til lavmolekylære dekstraner er albuminløsninger et effektivt middel for å øke blodets suspensjonsstabilitet. I den sene sjokkperioden forekommer generalisert aggregering av erytrocytter mot bakgrunn av en reduksjon i konsentrasjonen av albumin i blodplasmaet og en økning i konsentrasjonen av fibrinogen og globuliner, spesielt alfa2-fraksjonen, lipoproteiner og lipider. Under disse forholdene skyldes albumins reologiske effekter to hovedfaktorer: hemodilusjon og normalisering av forholdet mellom mikro- og makroglobulære proteiner i plasma. Samtidig binder albumin seg til frie syrer, hvis stabilisering under traumer og sjokk stimulerer aggregeringen av cellulære strukturer i blodet og intravaskulær koagulasjon, og kan forårsake fettemboli.
Antisjokktiltak som tar sikte på å fylle opp volumet av sirkulerende blod, eliminere vevshypoksi og metabolsk acidose, bidrar til normalisering av elastisiteten til erytrocyttmembranene, siden hypoksi og acidose reduserer erytrocyttenes deformerbarhet betydelig. Økt stivhet av erytrocyttmembraner i sjokk er sannsynligvis assosiert med hemming av ATP-syntese i erytrocytter. En reduksjon i ATP-konsentrasjonen bidrar igjen til en økning i konsentrasjonen av Ca2+ i erytrocytter, som ved å binde seg til membranproteiner øker membranens stivhet.
Et av de farmakologiske legemidlene som øker ATP-innholdet i erytrocytter og elastisiteten til erytrocyttmembranene er Trental (pentoksifyllin), som brukes i klinisk praksis for å behandle iskemiske lidelser.
Sammen med å redusere stivheten til erytrocytmembraner, forårsaker Trental vasodilatasjon, forbedrer vevsoksygenering, hemmer fosfodiesteraseaktivitet i vev, øker cAMP-konsentrasjonen og hemmer blodplateaggregering.
Blant andre farmakologiske midler som opprettholder elastisiteten til erytrocyttmembranen, er det verdt å merke seg Ca2+-antagonister, som begrenser strømmen av ioner inn i erytrocytter (flunarizin, nifedipin, etc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Oppmerksomhet!
For å forenkle oppfatningen av informasjon, blir denne instruksjonen for bruk av stoffet "Legemidler som forebygger trombose og forbedrer blodets reologi" oversatt og presentert i en spesiell form på grunnlag av de offisielle instruksjonene for medisinsk bruk av stoffet. Før bruk les annotasjonen som kom direkte til medisinen.
Beskrivelse gitt for informasjonsformål og er ikke en veiledning for selvhelbredelse. Behovet for dette legemidlet, formålet med behandlingsregimet, metoder og dose av legemidlet bestemmes utelukkende av den behandlende lege. Selvmedisin er farlig for helsen din.

