Medisinsk ekspert av artikkelen
Nye publikasjoner
Hjertekateterisering
Sist anmeldt: 06.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
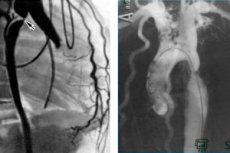
Kateterisering av hjertehulrommene utføres ved punktering og perkutan innføring av et kateter i et kar - en perifer vene (ulnar, subclavia, jugular, femoral) for de høyre hjertekamrene eller en arterie (brachial, femoral, aksillær, radial) for de venstre hjertekamrene.
Metodikk for å utføre hjertekateterisering
Ved alvorlig innsnevring av aortaklaffen eller dens kunstige protese, når det er umulig å føre et kateter retrograd inn i venstre ventrikkel, brukes en transseptal punktering av det interatrielle septum fra høyre atrium til venstre og deretter inn i venstre ventrikkel. Den mest brukte tilnærmingen til karet er i henhold til Seldinger-metoden (1953). Etter lokalbedøvelse av hud og subkutant vev med 0,5-1% novokainløsning eller 2% lidokainløsning og et lite hakk på huden, punkteres en vene eller arterie med en nål; når blod kommer ut av den proksimale spissen av nålen (paviljongen) (det er nødvendig å prøve å punktere bare den fremre veggen av karet), føres en føringstråd gjennom nålen, nålen fjernes og et kateter føres inn i karet langs føringstråden, som naturligvis skal være lengre enn kateteret. Kateteret føres frem til ønsket sted under røntgenkontroll. Ved bruk av flytende katetre av Swan-Gans-typen med en ballong i enden, bestemmes plasseringen av kateterspissen av trykkkurven. Det er å foretrekke å installere en tynnvegget introduser med en hemostatisk ventil og en sidegren for spyling inn i karet, og gjennom den er det enkelt å sette inn kateteret og erstatte det med et annet om nødvendig. Kateteret og introduseren vaskes med heparinisert isotonisk natriumkloridløsning for å forhindre trombedannelse. Ved bruk av forskjellige typer katetre er det mulig å nå forskjellige deler av hjertet og karene, måle trykk i dem, ta blodprøver for oksimetri og andre tester, introdusere RVC for å bestemme anatomiske parametere, innsnevringer, blodutskillelse osv.
Hvis det ikke er fluoroskopisk (røntgen) kontroll over kateterets plassering, brukes katetre med en oppblåsbar flytende ballong i enden, som kan bevege seg med blodstrømmen inn i høyre atrium, høyre ventrikkel, lungearterien og registrere trykket i dem. Kiletrykket i lungearterien tillater indirekte bedømmelse av tilstanden til venstre ventrikkelfunksjonen, dens endediastoliske trykk (EDP), siden venstre ventrikkels EDP er gjennomsnittstrykket i venstre atrium eller trykket i lungekapillærene. Dette er viktig for overvåking av behandling i tilfeller av hypotensjon, hjertesvikt, for eksempel ved akutt hjerteinfarkt. Hvis kateteret har tilleggsutstyr, er det mulig å måle hjerteminuttvolum ved hjelp av fargestofffortynning eller termodilusjon, registrere et intrakavitært elektrogram og utføre endokardiell stimulering. De intrakavitære trykkkurvene registreres ved hjelp av en Statham væsketrykksensor og et EKG på en jetopptaker eller datamaskin med mulig utskrift på papir; endringene deres kan brukes til å bedømme en bestemt hjertepatologi.
Måling av hjerteminuttvolum
Det skal bemerkes at det ikke finnes helt nøyaktige metoder for å måle hjerteminuttvolum. Under hjertekateterisering brukes oftest tre metoder for å bestemme hjerteminuttvolum: Fick-metoden, termodilusjonsmetoden og angiografisk metode.
Ficks metode
Den ble foreslått av Adolph Fick i 1870. Metoden er basert på antagelsen om at oksygentilførselen til lungene i hvile er lik mengden oksygen som utnyttes av vevet, og mengden blod som utstøtes av venstre ventrikkel er lik volumet av blod som strømmer gjennom lungene. Blandet venøst blod må tas, siden oksygenkonsentrasjonen i blodet i vena cava og sinus coronarius varierer betydelig. Blod tas fra høyre ventrikkel eller lungearterien, som er å foretrekke. Den arteriovenøse oksygenforskjellen kan bestemmes ut fra oksygenkonsentrasjonen i arterielt (Ca) og venøst (Cv) blod. Ved å beregne oksygeninnholdet som absorberes i løpet av 1 minutt, kan volumet av blod som strømmer gjennom lungene i løpet av samme tidsperiode beregnes, dvs. hjertets minuttvolum (CO):
MO = Q / Ca - St (l/min),
Hvor Q er kroppens oksygenopptak (ml/min).
Når du kjenner hjerteindeksen, kan du beregne hjerteindeksen (KI). For å gjøre dette, divider hjerteindeksen med pasientens geloverflateareal, som beregnes basert på høyde og kroppsvekt. Hjerteindeksen hos en voksen er normalt 5–6 l/min, og KI er 2,8–3,5 l/min/ m2.
Termodilusjonsmetode
Denne metoden bruker en avkjølt isotonisk natriumkloridløsning (5–10 ml), som føres inn i høyre atrium gjennom et flerlumenkateter. Kateterspissen med termistoren er i lungearterien. Kalibrering av kurvene utføres ved å kort slå på en konstant motstand, noe som gir avvik i registreringsenheten som tilsvarer en viss temperaturendring for en gitt termistor. De fleste termodilusjonsenheter er utstyrt med analoge dataenheter. Moderne utstyr tillater opptil 3 målinger av blodets MO i løpet av 1 minutt og flere repetisjoner av studiene. Hjerteminuttvolum, eller MO, bestemmes av følgende formel: MO = V (T1 - T2) x 60 x 1,08 / S (l/min),
Hvor V er volumet av den introduserte indikatoren; T1 er blodtemperaturen; T2 er indikatortemperaturen; S er arealet under fortynningskurven; 1,08 er koeffisienten avhengig av den spesifikke tettheten og varmekapasiteten til blodet og den isotoniske natriumkloridløsningen.
Fordelene med termodilusjon, samt behovet for kateterisering av kun venesengen, gjør denne metoden til den mest akseptable for å bestemme hjertets minuttvolum i klinisk praksis for tiden.
Noen tekniske aspekter ved kateteriseringslaboratoriet
Personalet ved kateteriseringsangiografilaboratoriet inkluderer leder, leger, operasjonssykepleiere og røntgenteknikere (røntgenteknikere) dersom det brukes filmopptak og storformatrøntgenopptak. I laboratorier som kun bruker videofilmer og databasert bildeopptak, er det ikke behov for røntgenteknikere. Alt laboratoriepersonell må være dyktige i hjerte-lunge-redningsteknikker, og for dette må røntgenoperasjonsstuen ha passende medisiner, en defibrillator, et apparat for elektrisk stimulering av hjertet med et sett elektrodekatetre, en sentral oksygenforsyning og (helst) et apparat for kunstig ventilasjon av lungene.
Komplekse og risikable diagnostiske prosedyrer og PCI (angioplastikk, stenting, aterektomi, etc.) bør fortrinnsvis utføres i klinikker med et hjertekirurgisk team. I henhold til anbefalingene fra The American College of Cardiology/American Heart Association kan angioplastikk og undersøkelse av pasienter med høy risiko for komplikasjoner, AMI, utføres av erfarne, kvalifiserte spesialister uten tilstedeværelse av hjertekirurgisk støtte på sykehuset dersom pasienten ikke kan transporteres til et mer egnet sted uten ytterligere risiko. I Europa og noen andre land (inkludert Russland) utføres endovaskulære intervensjoner i økende grad uten tilstedeværelse av hjertekirurger, siden behovet for akutt hjertekirurgi for tiden er ekstremt lavt. En avtale med en nærliggende hjertekirurgisk klinikk er tilstrekkelig for akutt overføring av pasienten dit ved peri- og postprosedurale komplikasjoner.
For å opprettholde operatørenes egnethet, kvalifikasjoner og ferdigheter, må laboratoriet utføre minst 300 prosedyrer per år, og hver lege må utføre minst 150 diagnostiske prosedyrer per år. For kateterisering og angiografi kreves en enhet for høyoppløselig røntgenangiografi, et system for overvåking av EKG og intravaskulært trykk, arkivering og behandling av angiografiske bilder, sterile instrumenter og ulike typer katetre (forskjellige typer katetre for koronarangiografi er beskrevet nedenfor). Angiografienheten må være utstyrt med et tilbehør for kineangiografisk eller digital databasert bildeopptak og arkivering, ha mulighet til å innhente bilder online, dvs. umiddelbart med kvantitativ databasert analyse av angiogrammer.
Endringer i intrakavitære trykkkurver
Intrakavitære trykkkurver kan endre seg under ulike patologiske tilstander. Disse endringene tjener til diagnostikk ved undersøkelse av pasienter med ulike hjertepatologier.
For å forstå årsakene til trykkendringer i hjertets hulrom, er det nødvendig å ha en idé om de tidsmessige forholdene mellom de mekaniske og elektriske prosessene som skjer under hjertesyklusen. Amplituden til a-bølgen i høyre atrium er høyere enn amplituden til y-bølgen. Et overskudd av y-bølgen over a-bølgen i trykkkurven fra høyre atrium indikerer et brudd på fyllingen av atriumet under ventrikulær systole, noe som oppstår ved trikuspidalklaffinsuffisiens eller en defekt.
Ved trikuspidalstenose ligner trykkkurven i høyre atrium den i venstre atrium ved mitralstenose eller konstriktiv perikarditt, med en nedgang og et platå i mid- og sen diastole, typisk for forhøyet trykk under tidlig systole. Gjennomsnittlig venstre atriumtrykk samsvarer ganske tett med kiletrykket i pulmonalarterien og det diastoliske trykket i pulmonalstammen. Ved mitralinsuffisiens uten stenose er det en rask nedgang i trykk ved starten av systolen (en nedgang i y-bølgen), etterfulgt av en gradvis økning i sen diastole (diastase). Dette gjenspeiler oppnåelsen av likevekt mellom atrie- og ventrikkeltrykk i den sene fasen av ventrikkelfylling. I motsetning til dette, hos pasienter med mitralstenose, avtar y-bølgen sakte, mens trykket i venstre atrium fortsetter å avta gjennom hele diastolen, og det er ingen tegn til diastase av pulstrykket i venstre atrium, siden atrioventrikulærtrykkgradienten er bevart. Hvis mitralstenose er ledsaget av en normal sinusrytme, opprettholdes α-bølgen i venstre atrium, og sammentrekning av atriene forårsaker dannelsen av en stor trykkgradient. Hos pasienter med isolert mitralinsuffisiens er v-bølgen tydelig uttrykt og har en bratt synkende knebevegelse av y-linjen.
På venstre ventrikkels trykkkurve går EDP-punktet umiddelbart før starten av den isometriske kontraksjonen og er plassert umiddelbart etter a-bølgen før c-bølgen av venstre atriumtrykk. Venstre ventrikkels EDP kan øke i følgende tilfeller: hjertesvikt, hvis ventrikkelen opplever en stor belastning forårsaket av overdreven blodstrøm, for eksempel ved aorta- eller mitralinsuffisiens; venstre ventrikkelhypertrofi, ledsaget av en reduksjon i dens distensibilitet, elastisitet og ettergivelighet; restriktiv kardiomyopati; konstriktiv perikarditt; hjertetamponade forårsaket av perikardiell effusjon.
Ved aortastenose, som er ledsaget av obstruert blodutstrømning fra venstre ventrikkel og en økning i trykket i denne sammenlignet med det systoliske trykket i aorta, dvs. tilsynekomst av en trykkgradient, ligner venstre ventrikkels trykkkurve trykkkurven under isometrisk kontraksjon. Omrisset er mer symmetrisk, og det maksimale trykket utvikles senere enn hos friske individer. Et lignende bilde observeres ved registrering av trykk i høyre ventrikkel hos pasienter med pulmonalarteriestenose. Blodtrykkskurver kan også variere hos pasienter med forskjellige typer aortastenose. Ved klaffstenose observeres dermed en langsom og forsinket økning i den arterielle pulsbølgen, og ved hypertrofisk kardiomyopati erstattes den innledende kraftige trykkeøkningen av en rask nedgang og deretter en sekundær positiv bølge som reflekterer obstruksjon under systole.
Avledede indekser for intraventrikulært trykk
Endrings-/økningsraten for den intraventrikulære trykkkurven under den isovolumiske kontraksjonsfasen kalles den første deriverte - dр/dt. Tidligere ble den brukt til å vurdere kontraktiliteten til ventrikulær myokard. Verdien av dр/dt og den andre deriverte - dр/dt/р - beregnes fra den intraventrikulære trykkkurven ved hjelp av elektronisk og datateknologi. Maksimumsverdiene for disse indikatorene representerer indeksene for ventrikulær kontraksjonsrate og bidrar til å vurdere hjertets kontraktilitet og inotrope status. Dessverre tillater ikke det brede spekteret av disse indikatorene i forskjellige pasientkategorier å utvikle noen gjennomsnittlige standarder, men de er ganske anvendelige hos én pasient med innledende data og mot bakgrunnen av bruk av legemidler som forbedrer hjertemuskelens kontraktile funksjon.
Med tanke på at vi for tiden har i vårt arsenal av pasientundersøkelsesmetoder som ekkokardiografi i ulike modifikasjoner, datamaskin (CT), elektronstråle- og magnetisk resonansavbildning (MR), er disse indikatorene for diagnostisering av hjertesykdommer ikke like viktige som før.
Komplikasjoner ved hjertekateterisering
Hjertekateterisering er relativt trygt, men som enhver invasiv teknikk har den en viss prosentandel av komplikasjoner forbundet med både selve inngrepet og pasientens generelle tilstand. Bruken av mer avanserte og tynne atraumatiske katetre, lav-osmolære og/eller ikke-ioniske RVS, moderne angiografiske enheter med sanntids databehandling av bilder for invasive inngrep har redusert forekomsten av mulige komplikasjoner betydelig. Dermed overstiger ikke dødeligheten under hjertekateterisering i store angiografiske laboratorier 0,1 %. S. Pepine et al. rapporterer en total dødelighet på opptil 0,14 %, med 1,75 % for pasienter under 1 år, 0,25 % for personer over 60 år, 0,03 % for koronarsykdom i ett kar, 0,16 % for sykdom i tre kar og 0,86 % for venstre koronarsykdom. Ved hjertesvikt øker dødeligheten også avhengig av NUHA-klassen: ved I-II FC - 0,02 %, III og IV FC - henholdsvis 0,12 og 0,67 %. Hos noen pasienter er risikoen for alvorlige komplikasjoner økt. Dette er pasienter med ustabil og progressiv angina, nylig (mindre enn 7 dager) hjerteinfarkt, tegn på lungeødem på grunn av myokardiskemi, med sirkulasjonssvikt ved III-IV FC, alvorlig høyre ventrikkelsvikt, hjerteklaffefeil (alvorlig aortastenose og aortastenose med pulstrykk på mer enn 80 mm Hg), medfødte hjertefeil med pulmonal hypertensjon og høyre ventrikkelsvikt.
I en multivariat analyse av 58 332 pasienter var prediktorer for alvorlige komplikasjoner alvorlig hjertesvikt, hypertensjon, medfødt hjertesvikt, aorta- og mitralklaffsykdom, nyresvikt, ustabil angina og akutt hjerteinfarkt i løpet av de første 24 timene, og kardiomyopati. Hos 80 år gamle pasienter økte dødeligheten under invasive diagnostiske prosedyrer også til 0,8 %, og forekomsten av vaskulære komplikasjoner på punksjonsstedet nådde 5 %.


 [
[