Medisinsk ekspert av artikkelen
Nye publikasjoner
Gliom i hjernen
Sist anmeldt: 07.06.2024

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Blant de mange tumorprosessene i sentralnervesystemet diagnostiseres hjernens glioma ofte - dette uttrykket er kollektiv, neoplasmaet kombinerer alle diffuse oligodendrogliale og astrocytiske foci, astrocytom, astroblastom og så videre. En slik svulst kan ha en annen grad av malignitet, dannes fra glialstrukturer - celler lokalisert rundt nevroner. Hovedområdet for gliomer er cerebrale halvkuler, vegger i hjernens ventrikler og chiasma - området med delvis skjæringspunkt mellom synsnervefibre. Eksternt er svulsten et nodulært element av rosa eller rødlig fargetone, runde eller spindelformet konfigurasjon med utydelige grenser. [1]
Epidemiologi
I omtrent 5% av tilfellene er gliomer assosiert med arvelige patologier - spesielt neurofibromatose og andre syndromer med dominerende arv. Eksperter påpeker at det absolutte flertallet av hjernegliomer utvikler seg sporadisk - det vil si uten en klar årsak.
Totalt sett utgjør primære neoplasmer i sentralnervesystemet omtrent 2% av alle svulster, eller litt over 21 tilfeller per hundre tusen befolkning. Blant dem forekommer gliomer i 35-36% av tilfellene, og mer enn 15% av dem er glioblastomer.
I følge noen data påvirker glioma menn oftere enn kvinner - svulsten er spesielt vanlig blant mennesker over 50 år.
Den globale forekomsten av gliomer blant eldre har økt betydelig de siste tiårene. Årsakene til dette fenomenet er ennå ikke etablert.
I henhold til definisjonen av Verdens helseorganisasjon er tre hovedvarianter av glialsvulster, som er forskjellige i deres histologiske egenskaper, blitt identifisert. Dette er oligodendrogliomer, astrocytomer og kombinerte oligoastrocytomer. Forekomsten av hver undertype av lav ondartet patologi har ikke blitt bestemt pålitelig. Noen studier indikerer en økning i forekomsten av oligodendrogliomer fra 5% til 30% og en reduksjon i forekomsten av astrocytomer.
Glialsvulster er i stand til å infiltrere hjernevev, og det store flertallet av lavkvalitetsfoci blir ondartet i løpet av noen få år. [2]
Fører til Hjernegliomer
Hjerne glioma er en hel gruppe tumorprosesser, hvis vanlighet er deres formasjon fra glialstrukturer av CNS som ligger i hjernevevet. Slike svulster er delt inn i to histopatologiske varianter: høye ondartede og lave ondartede gliomer.
Kilden til vekstdannelse er neuroglia-celler (astrocytter, oligodendrocytter), som gir strukturelt grunnlag og levedyktighet av hjerneneuroner.
Glialtumorprosesser skiller seg sterkt i struktur, mutasjonsendringer i gener, aggressivitet, kliniske trekk, diagnostiske egenskaper, respons på behandling og prognose hos pasienter. Embryonale og ependymale neoplasmer i sentralnervesystemet - spesielt medulloblastomer og ependymomer - skiller seg i deres histologiske struktur, men er like når det gjelder behandling.
Glialelementer ble først klassifisert som en egen strukturell kategori av nervesystemet på slutten av 1800-tallet.
Neuroglia vev består av celler som har hjelpefunksjoner: trofisk, støtte, beskyttende, sekretorisk. Nevroner og gliocytter eksisterer sammen med hverandre, de danner sammen nervesystemet og er av stor betydning i de generelle prosessene i organismens vitale aktivitet.
Gliocytter er omtrent kategorisert i flere hovedformer: astrocytter, oligodendrocytter, ependymale celler og mikroglia.
Til dags dato kan ikke forskere svare på spørsmålet om pålitelige årsaker til dannelse av nevroglial tumor. Antagelig er et visst negativt bidrag gitt av radioaktive effekter, smittsomme sykdommer, rus (spesielt kjemisk, yrkesmessig). Den arvelige faktoren er også viktig.
Hjernegliomer oppstår fra unormale neurogliocytter som har en genetisk defekt som fører til unormal vekst og funksjonalitet - slike strukturer blir referert til som "umoden". Ufullstendige celler er oftere lokalisert i ett område, der svulsten dannes.
Enkelt sagt er glialdannelse et resultat av kaotisk og sporadisk vekst av modifiserte neuroglia-celler. Prosessen kan utvikle seg fra ependymocytter, oligodendrocytter, astrocytter (astrocytom, inkludert gigantcelle og anaplastisk). [3]
Risikofaktorer
Til tross for at eksperter ikke nøyaktig kan karakterisere årsakene til dannelsen av glial-onkopatologier, kan i noen tilfeller deres utseende forhindres ved å eliminere de viktigste risikofaktorene:
- Ioniserende stråleeksponering har kreftfremkallende aktivitet, kan forårsake utvikling av leukemi og dannelse av kreftprosesser med en tett struktur, inkludert i personer i ung alder. Hyppige og urimelige radiologiske medisinske prosedyrer, ultrafiolett stråling (inkludert solarium) tilhører også potensielle kreftfremkallende effekter og kan forårsake utseendet på svulster i forskjellige organer, inkludert hjernen.
- Yrkesbygde effekter, rus har ofte en årsakssammenheng med utviklingen av kreftsvulster. Produksjonen av gummi og glass, plantevernmidler og drivstoff, metaller og tekstiler, maling og laboratorireagenser anses som spesielt farlige. I fare er arbeidere i luftfarts-, kull- og metallindustrien, kjemisk og biproduktproduksjonsanlegg, byggematerialer og elektroder, drivstoff og smøremidler, plast og monomerer.
- Luft, vann og jordforurensning er ansvarlig for opptil 4% av alle kreftpatologier i verden. Kreftcinogener, som er til stede i store mengder i miljøet, kommer inn i kroppen med inhalert luft, drikkevann og mat. Å bo i økologisk utrygge områder - i nærheten av store industrianlegg, travle transportutvekslinger - regnes som spesielt farlig.
- Infeksjonspatologier - spesielt virusinfeksjoner - kan også skape forhold som er gunstige for utvikling av svulster. Det er viktig å huske på dette og å bli vaksinert på forhånd, samt å forhindre smittsomme og parasittiske sykdommer.
- Tobakk og alkohol rus anses som risikofaktorer for mange varianter av kreft, ikke bare hjernegliomer.
- Utilstrekkelig fysisk aktivitet, overvekt, feil ernæring, metabolske lidelser, hodeskader, vaskulære patologier - ytterligere stressfaktorer som kan provosere starten på intracellulære lidelser.
- Eldre alder er den vanligste perioden for utvikling av neoplasmer i kroppen, så de over 55 år bør ta spesiell vare på egen helse.
Imidlertid er den viktigste og mest betydningsfulle risikofaktoren for gliomutvikling arvelig disponering.
Patogenesen
Til dags dato har eksperter en rekke forutsetninger om utvikling av hjernegliomer. Hver teori har sine egne grunner, men den eneste riktige og pålitelige patogenetiske mekanismen forskere ennå ikke har identifisert. I de fleste tilfeller snakker vi om følgende faktorer i utviklingen av neoplasmer:
Embryogenesisvikt, som består i forstyrrelse av organlegging og dannelse av "gale" cellestrukturer;
- Eksponering for ioniserende stråler, potensielle kreftfremkallende stoffer i form av kjemiske midler, mattilsetningsstoffer osv.;
- Hode traumer;
- Genforstyrrelser gikk videre fra generasjon til generasjon ("familiær" glioma);
- Immunfunksjon, neuroinfeksjoner.
De fleste gliomer har diffus vekst, med penetrering i det omkringliggende normale hjernevevet. Avhengig av graden av malignitet, kan svulsten utvikle seg i flere år uten manifestasjon. Ved aggressiv forløp øker symptomatologien raskt over flere måneder.
En del av tumorigenesen skyldes dysembryogenetiske endringer.
Hjernestammen kan påvirkes på forskjellige nivåer: diffus hjernestamme glioma på sin side vil variere både anatomo-morfologisk og klinisk. Noen slike neoplasmer - spesielt glioma i quadriplegia-platen - kan være relativt godartet, uten tegn til progresjon. En pontinglioma er derimot preget av dens spesielle malignitet, aggressivitet og dårlig prognose.
Diffuse lesjoner av hjernestrukturer, der mer enn tre anatomiske soner i de store halvkule er involvert i den patologiske prosessen, med mulig periventrikulær divergens og passering gjennom corpus kaller gliomatose. [4]
Er hjernens gliom arvelig?
En godt påvist risiko for dannelse av hjernegliom er arvelig - det vil si tilstedeværelsen av lignende eller andre intracerebrale svulster i direkte forfedre eller i samme generasjon. Radioaktive eksponeringer og regelmessig eller langvarig kontakt med potensielle kreftfremkallende stoffer forverrer situasjonen.
Ikke bare kan gliomer arves, men også sykdommer som er ledsaget av økt tumorvekst uten henvisning til lokaliseringen-spesielt kan dette være neurofibromatosis type 1 og 2, Li-Fraumeni syndrom, Hippel-Lindau. Ofte i gliomceller blir endringer i visse gener eller kromosomer påvist.
De viktigste patologiene som er assosiert med utvikling av gliom hos mennesker, er oppsummert i tabellen:
Patologi |
Kromosom |
Gen |
Forskjellige neoplasma |
Li-Fraumeni syndrom |
17р13 |
TR53 |
Neuroektodermale neoplasmer, astrocytom. |
Neurofibromatose |
17Q11 |
NF1 |
Optisk nerve gliom, pilocytisk astrocytom, neurofibromatose |
Turcottes syndrom |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrocytom |
Tuberøs sklerose (Burnevilles syndrom). |
9q34, 16p13 |
TSC1, TSC2 |
Gigantocellulær subavhengymal astrocytom |
Uansett arten av glialsvulsten, enten det er en sporadisk sak eller en arvelig patologi, er det en lidelse med uttrykk for et patologisk endret gen. Bortsett fra neoplasmer dannet som et resultat av læringseffekter, forblir i andre situasjoner at årsakene til genetiske endringer er uklare.
Symptomer Hjernegliomer
Funksjoner ved fokal symptomatologi avhenger direkte av området lokalisering av hjernens gliom og blir en konsekvens av alle slags endokrine lidelser, komprimering av nervevev eller lokale destruktive prosesser.
Hvis neoplasmaet er lokalisert i parietalsonen, domineres en person av slike manifestasjoner som anfall, sensoriske lidelser, hørselshemming.
Når glioma er lokalisert i området med den dominerende halvkule, blir taleforstyrrelser, agraphia, agnosia oppdaget.
Temporale lob-neoplasmer blir ofte ledsaget av krampaktige anfall, afasi, nedsatt luktesans og visuell funksjon, og dyspné.
Når intrakranielt trykk øker, utvikler et tilsvarende bilde med begrensning av synsfelt, lammelse av øyemuskulatur og hemiplegi.
På grunn av tumorprosessens spesifisitet, er hjernens gliom alltid ledsaget av nevrologiske symptomer i større eller mindre grad. Til å begynne med er det en merkbar generell svakhet, pasienten ønsker stadig å sove, arbeidsevne er nedsatt, tankeprosesser blir bremset. Det er på dette stadiet at det er en høy risiko for å stille en feil diagnose og som en konsekvens foreskrive feil behandling. Blant andre ikke-spesifikke manifestasjoner:
- Vestibulære lidelser, inkludert ustabil gang, tap av balanse (f.eks. Når du sykler eller klatrer opp trapper), nummenhet i lemmene osv.;
- Gradvis forverring av synet, dobling av det visuelle bildet;
- Forverring av auditiv funksjon;
- Slurvet tale;
- Kvalme og oppkast i form av angrep uavhengig av mat eller drikke;
- Svekkelse av mimiske muskler og andre ansiktsmuskler;
- Ubehag når du svelger;
- Regelmessig hodepine (ofte i morgentimene).
Det kliniske bildet utvides og forverres gradvis: Hos noen pasienter skjer det sakte, i andre - brått, bokstavelig talt "foran øynene", i løpet av noen uker. I sistnevnte tilfelle snakker vi om en aggressiv, raskt utviklende gliom i hjernen.
Første tegn
Glioma i hjernen i de tidlige stadiene av utvikling har ikke en uttalt symptomatologi. De første manifestasjonene blir ofte forvekslet med tegn på andre, mindre farlige patologier.
Generelt er det kliniske bildet av glioma mangfoldig og bestemmes av plasseringen og størrelsen på det patologiske fokuset. Når neoplasma vokser, utvikler generelle cerebrale symptomer og øker:
- Vedvarende og regelmessig hodesmerter som ikke reagerer på standard medisiner (ikke-steroide antiinflammatoriske medisiner);
- Intermitterende kvalme, noen ganger til oppkast;
- En ubehagelig, tung følelse i øyeeplområdet;
- Anfall.
Cerebrale manifestasjoner er spesielt intense når svulsten vokser inn i ventriklene eller brennevinssystemet. Cerebrospinalvæskedrenasje er nedsatt, intrakranielt trykk øker og hydrocephalus utvikler seg. Prosessen påvirker en viss del av hjernen, som påvirker utviklingen av den tilsvarende klinikken:
- Det er problemer med visuell funksjon;
- Talehemmede;
- Vestibulære lidelser (svimmelhet, nedsatt koordinering av bevegelser) forekommer;
- Parese, lammelse av armene, bena;
- Hukommelse og konsentrasjon er svekket;
- Tankeprosesser er svekket;
- Atferdsforstyrrelser dukker opp.
På det første stadiet er symptomene praktisk talt fraværende, eller de er så ubetydelige at de ikke tiltrekker seg oppmerksomhet. Det er av denne grunn at eksperter sterkt anbefaler regelmessige forebyggende undersøkelser og sjekk. Tross alt, jo tidligere tumorprosessen blir oppdaget, jo større er sjansene for kur og overlevelse. [5]
Glioma i hjernen hos et barn
Blant de mange hjernesvulstene som finnes i barndommen, varierer prosentandelen av gliomer fra 15 til 25%. Barn kan få sykdommen i begynnelsen av tenårene og begynnelsen av tjueårene, selv om det er veldig sjelden at babyer under 3 år skal få sykdommen.
Patologien starter på bakgrunn av mutasjon av glialceller. Til dags dato er det ikke noe svar på spørsmålet om hvorfor denne mutasjonen oppstår.
Det eneste som har blitt lært pålitelig, er at visse arvelige sykdommer forbundet med økt risiko for tumorvekst øker sannsynligheten for å utvikle hjernegliom også.
I tillegg har forskere funnet at glialceller kan ha divergens i individuelle gener eller kromosomer. På grunn av denne lidelsen sparker en mutasjonsmekanisme inn, som ikke er arvelig. Det er mulig at dette skjer i et av de tidligste stadiene av utviklingen.
Det er et bevist faktum at tilstedeværelsen av akutt leukemi eller retinoblastom i barnets historie, eller hjernestråling av noen annen grunn, øker risikoen for gliomdannelse betydelig (etter en viss periode).
Symptomatologi i barndommen avhenger av graden av malignitet og lokalisering av det patologiske fokuset. Det skilles mellom spesifikke og ikke-spesifikke symptomer:
- Ikke-spesifikke symptomer er ikke "bundet" til området der glioma ligger. Vanlige manifestasjoner kan omfatte hodesmerter, svimmelhet, dårlig appetitt, oppkast uten tilknytning til matinntak, vekttap (av ukjente årsaker), konstant følelse av tretthet, fall i akademiske ytelser, vanskeligheter med konsentrasjon, atferdsforstyrrelser. Disse tegnene skyldes komprimering av intrakranielle strukturer, som kan forklares som et direkte trykk av den voksende massen, og en lidelse i sirkulasjonen av cerebrospinalvæske. Det er fare for cerebral hydrocele.
- Den spesifikke symptomatologien avhenger av den umiddelbare plasseringen av glialpatologisk fokus. For eksempel er cerebellar tumor vanligvis ledsaget av nedsatt ganglag og balanse hos barn. Lesjonen av den store hjernen manifesteres ved krampaktige anfall, og tumorvekst i ryggmargen - lammelse av muskulaturen. Det hender at babyens visjon forverres skarpt, bevisstheten blir forstyrret, søvn er nedsatt, eller at et annet utviklingsproblem oppstår.
Som regel avslører ondartet gliom i barndommen seg i løpet av noen uker eller måneder av dens utvikling: ofte preget av rask og ukontrollert vekst av neoplasmaet.
Barn med ondartede glialsvulster blir behandlet av leger ved pediatriske kliniske sentre som spesialiserer seg på pediatrisk onkologi. Som regel brukes kirurgisk behandling, stråling og cellegiftkurs.
Det viktigste behandlingstrinnet er nevrokirurgi. Jo mer radikal det er, jo bedre er barnets sjanser for en kur. Men kirurgisk inngrep er ikke alltid mulig: Spesielt kan det oppstå problemer med fjerning av gliomer i hjernestammen, så vel som med stråling for barn under 3 år.
Gliomer i den sentrale hjernen (mellomliggende og mellomhjerne) er vanskelig å fjerne fullstendig, da det er fare for skade på sunt vev. Hvis fullstendig reseksjon av svulsten er umulig, er pasienten foreskrevet palliativ behandling.
Barn med ondartede gliomer blir behandlet i henhold til standardiserte protokoller som er blitt bestemt gjennom strengt kontrollerte kliniske studier. De vanligste protokollene er som følger:
- Hit HGG 2007: Involverer behandling av barn i alderen 3-17 år.
- Hit SKK: Passer for spedbarn (opptil tre år) og involverer ikke strålebehandlinger.
Pediatrisk overlevelsesstatistikk for gliomer er generelt ikke veldig optimistiske. Imidlertid er det ikke i noe tilfelle mulig å forutsi effektiviteten av behandlingstiltak for et bestemt barn. Det er viktig å følge alle legens ordrer nøye, noe som øker sjansene for bedring betydelig.
Skjemaer
Gliomer kan være lav ondartet og høy ondartet, med intens vekst og en tilbøyelighet til å metastasere. Det er viktig å forstå at lav malignitet ikke er synonymt med tumorsikkerhet. Enhver hjerne-neoplasma skaper ekstra volum, presser hjernestrukturer, noe som fører til deres forskyvning og økt intrakranielt trykk. Som et resultat kan pasienten dø.
Det er to hovedtyper av ondartede astrocytomer. Dette er glioblastomer og anaplastiske astrocytomer, som er underinndelt i henhold til molekylære endringer. Sekundære ondartede svulster som utviklet seg fra astrocytomer og har en lav grad av malignitet, finnes ofte hos unge pasienter. Opprinnelig ondartede svulster av glial-type forekommer oftere hos eldre pasienter.
Avhengig av strukturell beliggenhet kommer gliomer inn:
- Supratentorial (med lokalisering over lillehjernen i området laterale ventrikler, store halvkule);
- Underendelt (med lokalisering under lillehjernen i den bakre kraniale fossa).
I henhold til histologiske trekk, skiller slike typer gliomer:
- Astrocytisk gliom er den vanligste. På sin side er det delt inn i nodulær og diffus (sistnevnte kan karakteriseres av rask vekst og et slagmønster).
- Oligodendroglioma - forekommer hos 5% av pasientene. Det har petrificates - forkalkningsområder, oftest i frontalben.
- Ependymal glioma - vokser fra strukturene som fører veggene i den sentrale kanalen i ryggmargen og ventriklene. Vokser ofte inn i tykkelsen på hjernestoffet, så vel som inn i hjernen.
Blandet patologiske foci som underavhengighet, oligoastrocytom, etc. er også mulig.
Alle gliomer er kategorisert i følgende trinn:
- Sakte voksende relativt godartede neoplasmer uten åpenbare kliniske symptomer.
- Sakte voksende "grenselinje" gliomer som gradvis forvandles til trinn III og utover.
- Ondartet glioma.
- Ondartet gliom med intens aggressiv vekst og spredning, med dårlig prognose.
Jo lavere stadium av malignitet, desto mindre sannsynlighet for metastase og gjentakelse av den fjernet neoplasma, og desto større er sjansene for å kurere pasienten. Den største faren utgjør av glioblastoma multiforme, en lav differensiert prosess med intensiv vekst og utvikling. [6]
Mulige og vanligste varianter av neurogliom:
- Glioma med hjernestamme og pontinlesjoner er lokalisert i området der hjernen kobles til ryggmargen. Det er der viktige nevrocenters som er ansvarlige for luftveis, hjerte og motorisk funksjon er lokalisert. Hvis denne sonen er skadet, forstyrres arbeidet med vestibulære og taleapparater. Det oppdages ofte i barndommen.
- Visuell gliom påvirker neurogliale celler som omgir synsnerven. Patologien forårsaker synshemming og eksoftalmos. Det utvikler seg oftere hos barn.
- Lav ondartet neurogliom er preget av langsom vekst, lokalisert oftere i de store halvkule og lillehjernen. Det forekommer oftere hos unge mennesker (ungdommer og unge voksne rundt 20 år).
- Glioma i korpus callosum er mer karakteristisk for individer mellom 40 og 60 år og er oftest representert av glioblastom.
- Glioma i chiasma er lokalisert i optisk veikrysssonen, så det er ledsaget av nærsynthet, tap av synsfelt, okklusiv hydrocephalus og nevroendokrine lidelser. Det kan forekomme i alle aldre, men påvirker ofte pasienter med neurofibromatose type I.
Komplikasjoner og konsekvenser
Gliomer av lav malignitet (grad I-II, svært ondartet - f.eks. Astrocytom, oligoastrocytom, oligodendroglioma, pleomorf xanthoastrocytoma, etc.) og høy malignitet (grad III-ev - glioblastoma, anaplastic olligodendendrogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloglogloTome. Grad IV gliomer er spesielt ondartede.
Hjernestamgliom har en veldig ugunstig prognose nettopp fordi neoplasmaet påvirker et slikt hjerneområde, der de viktigste nerveforbindelsene mellom hjernen og lemmene er konsentrert. Selv en ganske liten svulst i dette området er nok til å gjøre pasientens tilstand raskt forverres og provosere lammelse.
Ikke mindre ugunstige konsekvenser oppstår når andre hjerneområder påvirkes. Ofte er det en svulst i hjernebarken, som ikke gir en sjanse for en lang forventet levealder av pasienten, til tross for behandlingen. Det er ofte bare mulig å utsette døden.
I følge medisinsk statistikk er den fem år lange overlevelsesraten ofte bare 10-20%. Selv om disse tallene i stor grad er avhengige av både graden av malignitet og den eksakte lokaliseringen og volumet av kirurgisk inngrep utført. Etter fullstendig fjerning av det patologiske fokuset øker overlevelsesraten betydelig (noen ganger - opptil 50%). Mangel på behandling eller dens umulighet (av en eller annen grunn) er garantert å føre til pasientens død.
Flertallet av lave ondartede glialsvulster er i stand til å infiltrere hjernevev og ondartet over flere år.
Risikoen for gjentakelse av glioma anses av eksperter som "svært sannsynlig". Likevel skal behandling ikke forsømmes: Det er viktig å sikre en god livskvalitet så lenge som mulig.
Gjentagende gliomer har alltid en dårligere prognose enn primære svulster. Imidlertid oppnår moderne behandlingsprotokoller basert på terapeutiske optimaliseringsstudier ofte tilstrekkelig gode resultater for pasienter selv med svært ondartede neoplasmer.
Mulige utfall etter cellegift:
- Avmagring, avmagring, fordøyelsesforstyrrelser, orale sykdommer;
- Økt eksitabilitet av sentralnervesystemet, Asthenia;
- Forringelse av hørselsfunksjon, tinnitus og ringing i ørene;
- Anfall, depressive lidelser;
- Hypertensiv krise, endring i blodmønster;
- Nyresvikt;
- Allergiske prosesser, hårtap, utseende av pigmentflekker på kroppen.
Etter cellegift, bemerker pasienter en uttalt svekkelse av immunforsvaret, noe som kan forårsake utvikling av forskjellige smittsomme patologier.
Diagnostikk Hjernegliomer
En hjerne gliom kan mistenkes med følgende tegn:
- Pasienten har lokaliserte eller generaliserte anfall, som er karakteristiske for den kortikale plasseringen av neoplasmaet og dens langsomme utvikling. Epi-anfall finnes hos 80% av pasientene med gliomer med lav grad og hos 30% av pasientene med høykvalitets gliomer.
- Økt intrakranielt trykk er spesielt karakteristisk for masser lokalisert i høyre frontal og parietal lober. Assosiert med høy intrakraniell trykkforstyrrelse av blodsirkulasjon og brennevinssirkulasjon innebærer utseendet til konstant og økende hodesmerter, kvalme med oppkast, visuelle forstyrrelser, døsighet. Det er ødem i synsnerven, lammelse av den avledingsnerven. En økning i intrakranelt trykk mot kritiske verdier kan føre til utvikling av koma og død. En annen årsak til høy IOP er Hydrocephalus.
- Pasienten har et voksende fokusbilde. I supratentorialformasjoner blir motor- og sensoriske sfærer forstyrret, hemiopia, afasi og kognitive lidelser fremgang.
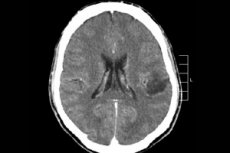
Hvis legen mistenker tilstedeværelsen av en neoplasma i hjernen, er det optimalt å utføre MR uten eller med introduksjon av kontrastmiddel (gadolinium) å finne ut dens beliggenhet, størrelse og tilleggsegenskaper. Hvis magnetisk resonansavbildning ikke er mulig, utføres beregnet tomografi, og magnetisk resonansspektroskopi brukes som en metode for differensiering. Til tross for informativiteten til disse diagnostiske metodene, stilles den endelige diagnosen bare etter histologisk bekreftelse under reseksjon av tumorfokuset.
Gitt kriteriene ovenfor, anbefales det å starte diagnose med en grundig historie, vurdering av somato-nevrologisk status og funksjonell status. Nevrologisk status blir vurdert sammen med bestemmelse av sannsynlige intellektuelle og mnestiske lidelser.
Anbefalte laboratorietester:
- En fullverdig generell klinisk blodopparbeiding;
- Et fullt blodkjemi-panel;
- Urinalyse;
- Blodkoagulasjonsstudie;
- Analyse for onkologiske markører (AFP, Beta-HCG, LDH - Relevant hvis det er mistanke om en lesjon av pinealsonen).
For å tydeliggjøre prognostiske punkter hos pasienter med glioblastom og anaplastisk astrocytom, blir IDH1 | 2-1 genmutasjon og MGMT-genetylering evaluert. Hos pasienter med oligodendroglioma og oligoastrocytoma bestemmes 1P | 19Q CODLELLATION.
Instrumental diagnostikk er først og fremst representert ved obligatorisk magnetisk resonansavbildning av hjernen (noen ganger - og ryggmarg). MR utføres i tre anslag ved bruk av standard T1-2, Flair, T1-modus med kontrast.
Når det er indikert, blir ultralyd av det vaskulære nettverket, funksjonell magnetisk resonansavbildning av motor- og taleseksjonene, samt angiografi, spektroskopi, MR-traktografi og perfusjon utført.
Ytterligere undersøkelser kan omfatte:
- Elektroencefalografi av hjernen;
- Konsultasjoner med en nevrokirurg, onkolog, radiolog, øyelege, radiolog.
Differensiell diagnose
Differensialdiagnose blir nødvendigvis utført med ikke-tumorpatologier-spesielt med blødning forårsaket av arterio-venøs eller arteriell misdannelse, så vel som med pseudotumor demyeliniserende prosesser, inflammatoriske sykdommer (toksoplasmose, hjerne abscess, etc.).
I tillegg kan differensiere det primære tumorfokuset og metastasene i sentralnervesystemet.
Med moderne magnetisk resonansavbildningsevne er det mulig å utføre diagnostiske tiltak nøyaktig nok, for å finne ut opprinnelsen til hovedfokuset i CNS. MR av hjernen utføres med eller uten kontrast, i T1, T2 Flair-modus - i tre projeksjoner, eller tynne skiver i aksial projeksjon (SPGR-modus). Disse diagnostiske metodene gjør det mulig å bestemme neoplasmaet nøyaktig å bestemme plasseringen, størrelsen, strukturelle egenskapene til neoplasma, forholdet til det vaskulære nettverket og hjerneområdene i nærheten.
I tillegg kan CT (med eller uten kontrast), CT-angiografi (MR-angiografi), MR-traktografi, MR eller CT-perfusjon utføres som en del av differensialdiagnosen. CT/PET av hjernen med metionin, kolin, tyrosin og andre aminosyrer brukes når det er indikert.
Behandling Hjernegliomer
Spesifikk terapi består av kirurgiske, kjemoterapeutiske og strålingstiltak. Det er om mulig obligatorisk å utføre en fullstendig reseksjon av tumorfokuset, noe som gir rask symptomlindring og histologisk bekreftelse av diagnosen.
Bestråling har en positiv effekt på å øke forventet levealder for pasienter. En total dose på 58 til 60 Gy, delt inn i individuelle bestrålingsdoser på 1,8-2 Gy, administreres som standard. Svulsten blir bestrålet lokalt, i tillegg fanger opptil 3 cm rundt den. Strålebehandling er mer akseptabel i motsetning til brachyterapi. I noen tilfeller anbefales radiosurgiske metoder, som består av bestråling med en gammakniv eller lineær gasspedal, samt nøytronfangst borbehandling.
Behovet for adjuvant cellegift er kontroversielt. I noen tilfeller tillot nitrosourea-preparater å øke forventet levealder for pasienter opp til halvannet år, men noen resultater av bruk av slike kjemoforberedelser var negative. I dag brukes cytotoksiske midler, neoadjuvant terapi (før stråling), kombinerte medisiner, intra-arteriell cellegift eller høydose cellegift med ytterligere stamcelletransplantasjon aktivt.
Generelt, for vellykket behandling av gliomer, er en omfattende tilnærming veldig viktig, hvis omfang avhenger av plasseringen og graden av malignitet i massen, dens størrelse og den generelle helsen til pasienten.
I forhold til hjernestamme glioma brukes sjelden kirurgisk inngrep. Den viktigste kontraindikasjonen for kirurgi er området for lokalisering av fokuset - i nærheten av viktige deler. I noen tilfeller er det mulig å fjerne glioma i bagasjerommet ved bruk av mikrosurgiske metoder, med preoperativ og postoperativ cellegift. Slik intervensjon er veldig kompleks og krever spesielle kvalifikasjoner av en nevrokirurg.
Strålekirurgi og spesielt stereotaktisk kirurgi med eksponering for høye ioniserende doser er ganske effektiv. Bruken av en slik teknikk i tidlige stadier av neoplasmautvikling gjør det noen ganger å oppnå langvarig remisjon eller til og med fullstendig kur av pasienten.
Stråling er ofte kombinert med cellegift, noe som forbedrer effekten av intervensjoner og reduserer strålingsbelastningen. I gliomer er ikke alle kjemoprevensive midler terapeutisk vellykkede, så de blir foreskrevet individuelt og reseptene justeres om nødvendig.
For å redusere smerter og lavere intrakranielt trykk, uavhengig av hovedbehandling, er symptomatisk terapi foreskrevet - spesielt kortikosteroidmedisiner, smertestillende midler, beroligende midler.
Medisiner
Kortikosteroidmedisiner påvirker hevelse, reduserer alvorlighetsgraden av nevrologiske symptomer i flere dager. På grunn av flere bivirkninger og økt sannsynlighet for uønskede interaksjoner med cellegiftmedisiner, brukes minimalt effektive doser av steroider, og avslutter dem så snart som mulig (f.eks. Etter operasjonen).
Antikonvulsiva brukes systematisk som et sekundært forebyggende tiltak hos pasienter som allerede har opplevd epileptiske anfall. Disse medisinene kan forårsake alvorlige bivirkninger og også samhandle med cellegiftmedisiner.
Antikoagulantia er spesielt relevante i det postoperative stadiet, siden risikoen for tromboflebitisdannelse i glioma er ganske høy (opptil 25%).
En god effekt forventes fra å ta antidepressiva-anxiolytika. Bruken av metylfenidat 10-30 mg/dag i to doser gjør det ofte å optimalisere kognitive evner, forbedre livskvaliteten, opprettholde arbeidskapasiteten.
Nevrologisk svikt og tegn på cerebralt ødem (smerter i hodet, bevissthetsforstyrrelser) elimineres av kortikosteroidmedisiner - spesielt prednisolon eller dexametason. |
Ordningen og doseringen av kortikosteroider velges individuelt, med utøvelse av den minste effektive dosen. På slutten av behandlingsforløpet blir medisinene gradvis trukket tilbake. |
Kortikosteroider blir tatt sammen med gastrotektive medisiner-protonpumpeblokkere eller H2-histaminBlokkering. |
Diuretika (furosemid, mannitol) er foreskrevet for alvorlig hevelse og forskyvning av hjernestrukturer, som et tillegg til kortikosteroidmedisiner. |
Ved krampaktige anfall (inkludert anamnesis) eller epileptiforme symptomer på elektroencefalogram, er antikonvulsiv terapi i tillegg foreskrevet. Antikonvulsiva er ikke foreskrevet for profylaktiske formål. |
Pasienter med indikasjoner for cellegift anbefales å ta antikonvulsiva som ikke påvirker leverenzymfunksjonen. Valgte medisiner: lamotrigin, valproic acid, levetiracetam. Bør ikke brukes: karbamazepin, fenobarbital. |
Hodesmerter i hjernegliomas styres med kortikosteroidbehandling. |
I noen tilfeller av hodepine kan ikke-steroide antiinflammatoriske medisiner eller tramadol brukes. |
Hvis pasienten tar ikke-steroide antiinflammatoriske medisiner, blir de avbrutt noen dager før operasjonen for å minimere sjansen for blødning under operasjonen. |
I utvalgte smertesaker kan narkotiske smertestillende midler - som fentanyl eller trimeperidin - anbefales. |
For å forhindre lungeemboli fra den tredje postoperative dagen, er administrering av hepariner med lav molekylvekt - spesielt enoksaparin-natrium eller nadroparin kalsium - foreskrevet. |
Hvis pasienten er på systematisk antikoagulant eller antiaggregantbehandling, blir han overført til hepariner med lav molekylvekt senest en uke før kirurgisk inngrep, med deres videre tilbaketrekning en dag før operasjonen og gjenopptar 24-48 timer etter operasjonen. |
Hvis en pasient med gliom har venøs trombose i de nedre ekstremiteter, utføres behandling med direkte antikoagulantia. Muligheten for å plassere en cava-filter er ikke ekskludert. |
Cellegift for ondartede gliomer i hjernen
De grunnleggende antitumor-cellegiftregimene for gliomer anses å være:
- Lomustin 100 mg/m² på dag én, vincristin 1,5 mg/m² på dagene en og åtte, prokarbazin 70 mg/m² fra dag åtte til tjueførste kurs hver sjette uke.
- Lomustine 110 mg/m² hver sjette uke.
- Temozolomide 5/23 150 til 200 mg/m² fra dag en til dag fem, hver 28. dag.
- Temozolomid som en del av kjemoradiasjonsbehandling, 75 mg/m² hver dag som stråling blir gitt.
- Temozolomid med cisplatin eller karboplatin (80 mg/m²), og temozolomid 150-200 mg/m² på dagene 1 til 5 hver fjerde uke.
- Temozolomide 7/7 ved 100 mg/m² på dagene 1-8 og 15-22 av kurset, med en gjentakelse hver fjerde uke.
- Bevacizumab 5 til 10 mg/kg på dagene en og femten, og Irinotecan 200 mg/m² på dag en og femten, gjentatt hver fjerde uke.
- Bevacizumab 5 til 10 mg/kg på dag en, femten og tjue-ni, og Lomustine 90 mg/m² på dag en hver sjette uke.
- Bevacizumab 5 til 10 mg/kg på dagene en og femten, Lomustine 40 mg på dagene en, åtte, femten og tjueto, gjentatt hver sjette uke.
- Bevacizumab 5 til 10 mg/kg på dagene en og femten, gjentatt hver fjerde uke.
Cytostatiske medisiner hemmer i mange tilfeller vellykket vekst av tumorceller, men viser ikke selektivitet mot sunt vev og organer. Derfor har eksperter identifisert en rekke kontraindikasjoner der cellegift av glioma er umulig:
- Overdreven individuell følsomhet for kjemoprevensive midler;
- Nedbrytning av hjerte-, nyre-, leverfunksjon;
- Deprimert hematopoiesis i benmargen;
- Binyrefunksjonsproblemer.
Kjemoterapi administreres med ekstrem forsiktighet:
- Pasienter med betydelige forstyrrelser i hjerterytme;
- Med diabetes;
- For akutte virusinfeksjoner;
- Til eldre pasienter;
- Pasienter som lider av kronisk alkoholisme (kronisk alkoholinnslag).
Den mest alvorlige bivirkningen av kjemoprevensive medisiner er deres toksisitet: Cytostatics forstyrrer selektivt funksjonaliteten til blodceller og endrer sammensetningen. Som en konsekvens avtar blodplate- og erytrocyttmasse og anemi utvikler seg.
Før legen foreskriver en pasient et cellegiftforløp, tar legen alltid hensyn til graden av toksisitet av medisinene og de sannsynlige komplikasjonene etter bruken av dem. Kjemoterapikurs overvåkes alltid nøye av spesialister og regelmessig blodovervåking.
Mulige konsekvenser av cytostatisk terapi:
- Gauntness, avmagring;
- Vanskeligheter med å svelge mat, tørr slimhinne, periodontitt, dyspepsi;
- Sentralnervesystemets ustabilitet, manisk-depressive lidelser, anfallssyndrom, Asthenia;
- Forverring av auditiv funksjon;
- Økning i blodtrykket opp til utviklingen av hypertensiv krise;
- Reduksjon i blodplater, røde blodlegemer, hvite blodlegemer, flere blødninger, indre og ytre blødninger;
- Nyresvikt;
- Allergiske prosesser;
- Hårtap, utseendet til områder med økt pigmentering.
Etter kurs med cellegift har pasienter økt risiko for å utvikle smittsomme sykdommer, og muskel- og leddsmerter er vanlig.
For å redusere risikoen for ugunstige post-chemoterapeutiske effekter, er ytterligere rehabiliteringstiltak nødvendigvis foreskrevet, hvis formål er å gjenopprette normal blodtelling, stabilisering av kardiovaskulær aktivitet, normalisering av nevrologisk status. Tilstrekkelig psykologisk støtte praktiseres nødvendigvis.
Kirurgisk behandling
Operasjonen utføres for å fjerne tumorfokus så mye som mulig, som igjen skal redusere intrakranelt trykk, redusere nevrologisk insuffisiens og gi det nødvendige biomaterialet for forskning.
- Operasjonen utføres i en spesialisert nevrokirurgisk avdeling eller klinikk hvis spesialister har opplevd i nevro-onkologiske intervensjoner.
- Kirurgen utfører tilgang ved plastbentrepanering i området mistenkt Glioma-lokalisering.
- Hvis neoplasmaet ligger anatomisk nær motoriske områder eller veier, eller i kjernene eller langs kraniale nerver, brukes intraoperativ nevrofysiologisk overvåking.
- Neuronavigation-systemer, intraoperativ fluorescensnavigasjon med 5-aminolevulensyre er ønskelig for å maksimere fjerningen av neoplasmaet.
- Etter intervensjonen utføres en kontroll CT eller MR (med eller uten kontrastinjeksjon) på dag 1-2.
Hvis kirurgisk reseksjon av glioma er umulig eller opprinnelig anerkjent som billig, eller hvis lymfom i sentralnervesystemet mistenkes, utføres en biopsi (åpen, stereotaktisk, med navigasjonsovervåking osv.). |
Pasienter med cerebral gliomatose blir bekreftet ved stereotaktisk biopsi, siden terapeutiske taktikker i stor grad er avhengige av det histologiske bildet. |
I visse situasjoner - hos eldre pasienter, i tilfelle av alvorlige nevrologiske lidelser, i tilfelle lokalisering av gliom i bagasjerommet og andre viktige deler - er behandling planlagt basert på symptomer og avbildningsinformasjon etter en generell medisinsk konsultasjon. |
Pasienter med piloid astrocytom samt nodulære former for neoplasmer av hjernestam og eksofytiske prosesser anbefales å gjennomgå reseksjon eller åpen biopsi. |
Pasienter med diffus pontin glioma og andre diffuse neoplasmer av bagasjerommet blir behandlet med stråling og antitumormedisinbehandling. Verifisering er ikke nødvendig i slike tilfeller. |
Pasienter med quadriplegic plate glioma gjennomgår systematisk magnetisk resonans og klinisk overvåking etter fjerning av cerebral hydrocele. Hvis neoplasmaet viser tegn til vekst, fjernes den med ytterligere bestråling. |
Når delvis reseksjon eller biopsi av en malign glioma av lav grad utføres, blir pasienter med to eller flere risikofaktorer nødvendigvis behandlet med stråling og/eller cellegift. |
Total reseksjon er obligatorisk for pasienter med underavhengige gigantiske celle astrocytom. |
Everolimus er foreskrevet for diffus subpendymal gigantcelle astrocytom. |
Piloid astrocytom bør fjernes med magnetisk resonansavbildning etter intervensjon for å tydeliggjøre kvaliteten på radikal reseksjon av tumorvev. |
Ved glioblastom bør postoperativ terapi kombineres (stråling + cellegift) med temozolomidadministrasjon. |
I anaplastisk astrocytom etter operasjonen er strålebehandling med ytterligere medikamentell terapi indikert. Lomustine, Temozolomide brukes. |
Pasienter med anaplastisk oligodendrogliom eller oligoastrocytom får både stråling og cellegift (temozolomid eller PCV monoterapi) etter operasjonen. |
Eldre pasienter med omfattende høy ondartet gliom er bestrålet i hypofraksjonert modus, eller monoterapi med temozolomid utføres. |
Ved gjentakelse av glioma blir muligheten for reoperasjon og påfølgende behandlingstaktikker diskutert av et konsilium av spesialister. Det optimale regimet for tilbakefall: reoperasjon + systemisk cellegift + gjentatt strålingseksponering + palliative tiltak. Hvis det er lokaliserte mindre områder med tilbakevendende tumorvekst, kan radiokirurgi brukes. |
Valg av medikamenter for tilbakevendende gliomvekst er temozolomid og bevacizumab. |
Gjentakelse av svært ondartede oligodendrogliomer og anaplastiske astrocytomer er en indikasjon for temozolomidbehandling. |
Pleomorf Xanthoastrocytoma fjernes uten obligatorisk adjuvant cellegift. |
En av de særegenhetene ved gliomas er vanskeligheten med deres behandling og fjerning. Kirurgen tar sikte på å fjerne vevene i neoplasmaet så fullstendig som mulig, for å oppnå kompensasjon av tilstanden. Mange pasienter er i stand til å forbedre livskvaliteten og forlenge det, men for svært ondartede svulster forblir prognosen ugunstig: det er økt sannsynlighet for å vekst på det patologiske fokuset.
Ernæring for gliom i hjernen
Kosthold for pasienter med ondartede svulster - et viktig poeng, som dessverre mange ikke legger mye vekt på. I mellomtiden, takket være endringer i kostholdet, er det mulig å bremse utviklingen av glioma og styrke og rystet immunitet.
Store områder med kostholdsendring:
- Normalisering av metabolske prosesser, styrke immunbeskyttelse;
- Avgiftning av kroppen;
- Optimalisering av energipotensialet;
- Sikre normal funksjon av alle organer og systemer i kroppen i en så vanskelig periode for dem.
Rasjonalt og balansert kosthold er nødvendig, ettersom pasienter med tidlige stadier av lave ondartede neoplasmer, og pasienter med det siste stadiet av glioblastom. Nøye utvalgte kosthold bidrar til forbedring av generell velvære, utvinning av skadet vev, noe som er spesielt viktig på bakgrunn av cytostatisk og strålingsbehandling. Balansen mellom ernæringskomponenter og riktige metabolske prosesser forhindrer dannelse av smittsomme foci, blokkerer inflammatoriske reaksjoner, forhindrer utmattelse av kroppen.
Følgende mat og drikke anbefales for hjerne gliom:
- Røde, gule og oransje fargede frukt og grønnsaker (tomater, fersken, aprikoser, gulrøtter, rødbeter, sitrusfrukter) som inneholder karotenoider, som beskytter sunne celler mot de negative effektene av strålebehandling;
- Kål (blomkål, brokkoli, rosenkål), reddik, sennep og andre planteprodukter som inneholder indol - et aktivt stoff som nøytraliserer uheldige giftige og kjemiske faktorer;
- Greener (dill, persille, unge løvetann og brennesleblader, rabarbra, ruccola, spinat), grønne erter og asparges, aspargesbønner og alger (tang, spirulina, chlorella);
- Grønn te;
- Hvitløk, løk, ananas, som har antitumor og avgiftningsevne;
- Kli, frokostblandinger, fullkornsbrød, spirte spirer av belgfrukter, korn og frø;
- Mørke druer, bringebær, jordbær og jordbær, blåbær, bjørnebær, granateple, rips, solbær, rowanberries, blåbær, sjøbunn, kirsebær og andre bær som inneholder naturlige antioksidanter som reduserer de negative effektene av frie radikaler, virus og karkin;
- Lavfettmeieriprodukter.
Du bør ikke belaste fordøyelsessystemet og hele kroppen med tunge og fete matvarer. Det er nyttig å bruke ferskpressede hjemmelagde juice, smoothies, Morsels. Kilder til omega-3 fettsyrer, som fiskeolje, linfrøolje eller linfrø, bør tilsettes oppvasken.
Det er bedre å unngå sukker og søtsaker helt. Men en skje med honning med en kopp vann vil ikke skade: Bee-produkter har en uttalt betennelsesdempende, antioksidant og antitumorffekt. Den eneste kontraindikasjonen for bruk av honning er en allergi mot produktet.
Fra kostholdet bør utelukkes:
- Kjøtt, smult, innmat;
- Smør, fet meieriprodukter;
- Røkt kjøtt, pølser, hermetisk kjøtt og fisk;
- Alkohol i noen form;
- Søtsaker, kaker, kaker og kaker, godteri og sjokolade;
- Bekvemmelighetsmat, hurtigmat, snacks;
- Stekt mat.
Du bør konsumere nok grønnsaker, greener, frukt og rent drikkevann på daglig basis.
Under cellegift og i noen tid etter det, bør du drikke hjemmelaget grønnsaks- og fruktjuice, spise hjemmelaget cottage ost, melk og ost. Det er viktig å drikke rikelig med væsker, pusse tennene og skylle munnen ofte (ca. 4 ganger om dagen).
Optimale måltider for pasienter med hjernens gliom:
- Vegetabilske gryteretter;
- Side retter og supper laget av frokostblandinger (helst bokhvete, havregryn, ris, couscous, bulgur);
- Dampede ostekaker, puddinger, gryteretter;
- Stuet og bakte grønnsaker;
- Stews, grønnsaksupper, første og andre retter fra belgfrukter (inkludert soya), pâtés og soufflés;
- Smoothies, grønn te, kompott og stykker.
Forebygging
Hvis en person leder en sunn livsstil, og blant hans pårørende var det ingen tilfeller av kreftpatologi, har han enhver sjanse til ikke å få hjernegliom. Det er ingen spesifikk forebygging av slike svulster, så de viktigste forebyggende punktene anses å være riktig ernæring, fysisk aktivitet, unngåelse av dårlige vaner, fravær av yrkesmessige og husholdningsfarer.
Spesialister gir en rekke enkle, men effektive anbefalinger:
- Drikk mer rent vann, unngå søtet brus, pakket juice, energidrikker og alkohol.
- Unngå farer og husholdningsfarer: Mindre kontakt med kjemikalier, etsende løsninger og væsker.
- Forsøk å tilberede mat ved å koke, steke, bake, men ikke steke. Gi preferanse til sunn, hjemmelaget mat.
- En stor andel av kostholdet ditt skal være plantemat, inkludert greener, uavhengig av tiden på året.
- En annen negativ faktor er å bli overvektig, som bør bli kvitt. Vektkontroll er veldig viktig for helsen til hele kroppen.
- Vegetabilske oljer bør alltid foretrekkes fremfor smør og smult.
- Hvis det er mulig, er det ønskelig å foretrekke miljøvennlige produkter, kjøtt uten hormoner, grønnsaker og frukt uten nitrater og plantevernmidler. Det er bedre å unngå rødt kjøtt helt.
- Ikke ta multivitaminpreparater uten indikasjoner og i store mengder. Ikke ta medisiner uten resept på legen: Selvmedisinering er ofte veldig, veldig farlig.
- Hvis mistenkelige symptomer vises, er det nødvendig å besøke en lege, uten å vente på situasjonen forverring, utvikling av bivirkninger og komplikasjoner.
- Søtsaker og matvarer med høy glykemisk indeks er en uønsket komponent i kostholdet.
- Jo tidligere en person går til legene, jo bedre er sjansene hans for kur (og dette gjelder nesten enhver sykdom, inkludert gliom i hjernen).
For å forhindre dannelse av onkopatologi, trenger du nok tid til å sove og hvile, unngå overdreven forbruk av alkoholholdige drikker, gi preferanse til naturlig mat av høy kvalitet, redusere bruken av dingser (spesielt mobiltelefoner).
Tumorsykdommer forekommer ofte hos eldre og gamle mennesker. Derfor er det viktig å overvåke din egen helse fra ung alder og ikke å provosere patologiske prosesser ved usunn livsstil og usunne vaner.
De nøyaktige årsakene til onkologi er ennå ikke avklart. En viss rolle spiller selvfølgelig ugunstige yrkes- og miljømessige forhold, eksponering for ioniserende og elektromagnetisk stråling, hormonelle forandringer. Ikke hold deg lang og regelmessig under solen, tillat plutselige endringer i omgivelsestemperatur, overoppheting i badekaret eller badstuen, tar ofte varme bad eller dusjer.
Et annet spørsmål: Hvordan forhindre en gjentakelse av hjernegliom etter den vellykkede behandlingen? Gjentakelse av neoplasma-vekst er en kompleks og dessverre hyppig komplikasjon, noe som er vanskelig å forutsi på forhånd. Pasienter kan anbefales å gjennomgå regelmessige forebyggende undersøkelser og kontroller, besøke en onkolog og delta på lege minst to ganger i året, føre en sunn livsstil, spise sunn og naturlig mat, øve moderat fysisk aktivitet. En annen tilstand er kjærlighet til livet, sunn optimisme, positiv holdning til suksess under noen omstendigheter. Dette inkluderer også en vennlig atmosfære i familien og på jobb, tålmodighet og ubetinget støtte fra nære mennesker.
Prognose
Hjernenes tilstand og egenskapene til glioma på deteksjonstidspunktet påvirker overlevelsesraten like mye som behandlingen som ble administrert. En tilfredsstillende generell helse hos pasienten og hans alder forbedrer prognosen (prognosen er mer optimistisk hos unge pasienter). En viktig indikator er det histologiske bildet av neoplasmaet. Dermed har gliomer med lav kvalitet en bedre prognose enn anaplastiske gliomer og enda mer glioblastomer (de mest ugunstige tumorprosessene). Astrocytomer har en verre prognose enn oligodendrogliomas.
Ondartede astrocytomer reagerer dårlig på terapi og har en relativt lav overlevelsesrate på seks til fem år. Samtidig er forventet levealder i gliomer med lav kvalitet estimert til 1-10 år.
Ondartede astrocytomer er i det vesentlige uhelbredelige. Behandlingsretningen innebærer vanligvis å redusere nevrologiske manifestasjoner (inkludert kognitiv dysfunksjon) og øke forventet levealder og samtidig opprettholde høyest mulig livskvalitet. Symptomatisk terapi tiltrekkes på bakgrunn av rehabiliteringstiltak. Arbeidet til en psykolog er også viktig.
I løpet av det siste tiåret har forskere gjort noen fremskritt med å forstå hjernesvulstene og hvordan de skal behandle dem. Mye mer bør gjøres for å optimalisere prognosen for sykdommen. Spesialistens primære oppgave i dag er følgende: Brain Glioma bør ha flere ordninger for effektiv eliminering av problemet på en gang, både i tidlige og påfølgende utviklingsstadier.

