Medisinsk ekspert av artikkelen
Nye publikasjoner
Årsaker og patogenese av difteri
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
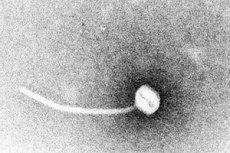
Difteri er et paradigme for toksigene infeksjonssykdommer. I 1883 demonstrerte Klebs at Corynebacterium diphtheriae var årsaken til difteri. Et år senere fant Loeffler ut at organismen kun kunne dyrkes fra nasofaryngealt hulrom og foreslo at skaden på indre organer skyldtes et løselig toksin. I 1888 viste Roux og Yersin at dyr injisert med sterile filtrater av C. diphtheriae utviklet organpatologi som ikke kunne skilles fra menneskelig difteri; dette demonstrerte at et potent eksotoksin var den viktigste virulensfaktoren.
Difteri er oftest en øvre luftveisinfeksjon som forårsaker feber, sår hals og uvelhet. En tykk, grågrønn fibrinmembran, en pseudomembran, dannes ofte på infeksjonsstedet(ene) som et resultat av de kombinerte effektene av bakterievekst, toksinproduksjon, underliggende vevsnekrose og vertens immunrespons. Erkjennelsen av at systemisk organskade skyldes virkningen av difteritoksin har ført til utviklingen av både effektiv antitoksinbasert terapi for behandling av akutt infeksjon og en svært effektiv toksoidvaksine.
Selv om toksoidvaksinasjon har gjort difteri til en sjelden sykdom i områder der folkehelsestandarder krever vaksinasjon, forekommer utbrudd av difteri fortsatt i uvaksinerte og immunkompromitterte grupper. I motsetning til dette har det forekommet omfattende utbrudd av difteri som har nådd epidemiske proporsjoner i områder der aktive vaksinasjonsprogrammer har blitt suspendert.
Andre typer korynebakterier
I tillegg til C. diphtheriae, C. ulcerans og C. pseudotuberculosis, kan C. pseudodiphtheriticum og C. xerosis av og til forårsake nasofaryngeale og hudinfeksjoner. De to sistnevnte stammene er gjenkjennelige ved sin evne til å produsere pyrazinamidase. Innen veterinærmedisin er C. renale og C. kutscheri viktige patogener, som forårsaker henholdsvis pyelonefritt hos storfe og latente infeksjoner hos mus.
Fører til
Det forårsakende agenset til difteri, Corynebacterium diphtheriae, er en tynn, svakt buet stav med klubbeformede fortykkelser i endene, ubevegelig; den danner ikke sporer, kapsler eller flageller, og er grampositiv.
I tillegg til toksinet produserer difteri-korynebakterier neuraminidase, hyaluronidase, hemolysin, nekrotiserende og diffuse faktorer i løpet av sine livsprosesser, noe som kan forårsake nekrose og flytendegjøring av hovedsubstansen i bindevevet.
Basert på deres evne til å danne toksin, er difteri-corynebakterier delt inn i toksigene og ikke-toksigene.
Difteritoksin er et potent bakterielt eksotoksin som bestemmer både generelle og lokale kliniske manifestasjoner av sykdommen. Toksigenisiteten er genetisk bestemt. Ikke-toksogene korynebakterier av difteri forårsaker ikke sykdommen.
I henhold til kulturelle og morfologiske trekk er alle difteri-korynebakterier delt inn i tre varianter: gravis, mitis og intermedius. Det er ingen direkte avhengighet av sykdommens alvorlighetsgrad på varianten av difteri-korynebakterier. Hver variant inneholder både toksigene og ikke-toksigene stammer. Toksigene korynebakterier av alle varianter produserer et identisk toksin. [ 1 ]
Struktur, klassifisering og antigentyper
Corynebacterium diphtheriae er en grampositiv, ikke-bevegelig, kølleformet stav. Stammer som vokser i vev eller eldre in vitro-kulturer inneholder fine flekker i celleveggene som tillater avfarging under gramfarging og resulterer i en variabel gramreaksjon. Eldre kulturer inneholder ofte metakromatiske granuler (polymetafosfat) som farges blålilla med metylenblått. Celleveggsukkerne inkluderer arabinose, galaktose og mannose. I tillegg kan den giftige 6,6'-esteren av trehalose isoleres, som inneholder korynemykolsyre og korynemykolensyre i ekvimolare konsentrasjoner. Tre forskjellige kulturtyper gjenkjennes: mitis, intermedius og gravis.
De fleste stammer krever nikotinsyre og pantotensyre for vekst; noen krever også tiamin, biotin eller pimelinsyre. For optimal produksjon av difteritoksin må mediet tilsettes aminosyrer og settes til side.
Så tidlig som i 1887 beskrev Loeffler isoleringen av avirulente (ikke-toksogene) C. diphtheriae som ikke kunne skilles fra virulente (toksogene) stammer isolert fra pasienter hos friske individer. Det er nå anerkjent at avirulente stammer av C. diphtheriae kan omdannes til en virulent fenotype etter infeksjon og lysogenisering av en av en rekke distinkte korynebakteriofager som bærer det strukturelle genet for difteritoksin, tox. Lysogen omdannelse av den avirulente til virulente fenotypen kan forekomme både in situ og in vitro. Det strukturelle genet for difteritoksin er ikke essensielt for verken korynebakteriofag eller C. diphtheriae. Til tross for denne observasjonen er det ikke observert genetisk drift av difteritoksin.
Patogenesen
Inngangspunkter for infeksjon er slimhinnene i orofarynx, nese, strupehode, sjeldnere slimhinnen i øynene og kjønnsorganene, samt skadet hud, sår- eller brannsår, bleieutslett, uhelet navlestreng. Ved inngangspunktet formerer difteri-corynebakterien seg og skiller ut eksotoksin.
Fibrinogenrikt ekssudat utskilles og omdannes til fibrin under påvirkning av trombokinase som frigjøres under nekrose av epitelceller. En fibrinøs film dannes – et karakteristisk tegn på difteri.
Asymptomatisk nasofaryngeal bæring er vanlig i difteriendemiske regioner. Hos mottakelige individer forårsaker toksigene stammer sykdom ved å replikere og utskille difteritoksin i nasofarynks eller hudlesjoner. Difteri-lesjonen er ofte dekket av en pseudomembran bestående av fibrin, bakterier og inflammatoriske celler. Difteritoksin kan proteolytisk spaltes i to fragmenter: N-terminalt fragment A (katalytisk domene) og fragment B (transmembrane og reseptorbindende domener). Fragment A katalyserer NAD+-avhengig ADP-ribosylering av elongasjonsfaktor 2, og hemmer dermed proteinsyntese i eukaryote celler. Fragment B binder seg til en celleoverflatereseptor og letter levering av fragment A til cytosolen.
Beskyttende immunitet involverer antistoffresponsen mot difteritoksin etter klinisk sykdom eller mot difteritoksin (toksin inaktivert av formaldehyd) etter immunisering.
Kolonisering
Lite er kjent om faktorene som medierer kolonisering av C. diphtheriae. Det er imidlertid klart at andre faktorer enn produksjon av difteritoksin bidrar til virulens. Epidemiologiske studier har vist at en gitt lysotype kan vedvare i en populasjon over lange perioder. Den kan senere bli erstattet av en annen lysotype. Fremveksten og den påfølgende dominansen av en ny lysotype i en populasjon er antagelig relatert til dens evne til å kolonisere og konkurrere effektivt i sitt segment av den nasofaryngeale økologiske nisjen. Corynebacterium diphtheriae kan produsere neuraminidase, som spalter celleoverflatesialinsyre i komponentene pyruvat og N-acetylneuraminsyre. Cordfaktor (6,6'-di-O-mykoloyl-α, α'-D-trehalose) er en overflatekomponent av C. diphtheriae, men dens rolle i koloniseringen av den menneskelige verten er uklar.
Produksjon av difteritoksiner
Det strukturelle genet til difteritoksin, tox, tilhører en familie av nært beslektede korynebakteriofager, hvorav β-fagen er den best studerte. Regulering av difteritoksinuttrykk medieres av en jernaktivert repressor, DtxR, som er kodet av C. diphtheriae-genomet. Toksinuttrykk avhenger av den fysiologiske tilstanden til C. diphtheriae. Under forhold der jern blir det veksthastighetsbegrensende substratet, dissosierer jern fra DtxR, toksikodendrongenet aktiveres, og difteritoksin syntetiseres og skilles ut i kulturmediet med maksimale hastigheter.
Difteritoksin er uvanlig potent; for mottakelige arter (f.eks. mennesker, aper, kaniner, marsvin) er så lite som 100 til 150 ng/kg kroppsvekt dødelig. Difteritoksin består av en enkelt polypeptidkjede på 535 aminosyrer. Biokjemisk, genetisk og røntgenstrukturanalyse viser at toksinet består av tre strukturelle/funksjonelle domener:
- N-terminal ADP-ribosyltransferase (katalytisk domene);
- et område som letter levering av det katalytiske domenet over cellemembranen (transmembrandomene);
- reseptorbindingsdomene for eukaryote celler.
Etter mild trypsinfordøyelse og reduksjon under denaturerende forhold kan difteritoksin spesifikt spaltes ved sin proteasefølsomme løkke i to polypeptidfragmenter (A og B). Fragment A er den N-terminale 21 kDa-komponenten av toksinet og inneholder det katalytiske stedet for ADP-ribosylering av forlengelsesfaktor 2 (EF-2).
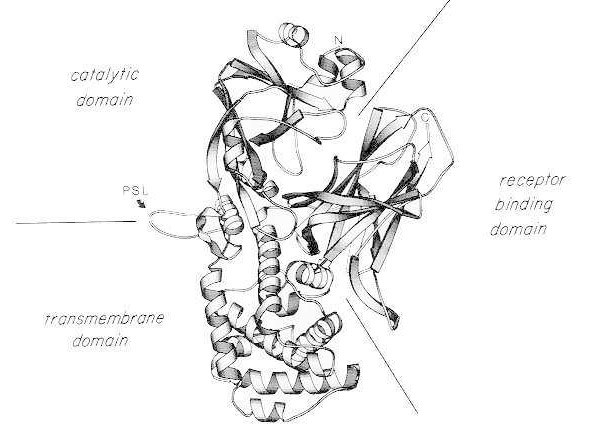
Bånddiagram av røntgenkrystallstrukturen til monomerisk nativt difteritoksin. (modifisert fra Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling alliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). De relative posisjonene til de katalytiske, transmembrane og reseptorbindende domenene er vist. Det intakte toksinet kan spaltes av trypsinlignende proteaser ved Arg190, Arg192 og/eller Arg193, som er lokalisert i den proteasefølsomme løkken (PSL). Etter reduksjon av disulfidbroen mellom Cys186 og Cys201, kan toksinet oppløses i A- og B-fragmenter. Aminoterminalen (N) og karboksyterminalen (C) til det intakte toksinet er vist. Strippeldiagrammet ble laget ved hjelp av MOLESCRIPT-programmet.
Det C-terminale fragmentet, fragment B, bærer transmembran- og reseptorbindende domener til toksinet.
Forgiftning av en enkelt eukaryot celle med difteritoksin involverer minst fire forskjellige trinn:
- binding av toksinet til reseptoren på celleoverflaten;
- gruppering av ladede reseptorer i belagte groper og internalisering av toksinet via reseptormediert endocytose; etter forsuring av den endocytiske vesikelen av en membranassosiert, ATP-drevet protonpumpe,
- innsetting av transmembrandomenet i membranen og forenklet levering av det katalytiske domenet til cytosolen, og
- ADP-ribosylering av EF-2, noe som resulterer i irreversibel undertrykkelse av proteinsyntese.
Det har blitt vist at et enkelt molekyl av det katalytiske domenet som leveres inn i cytosolen er tilstrekkelig til å være dødelig for cellen.
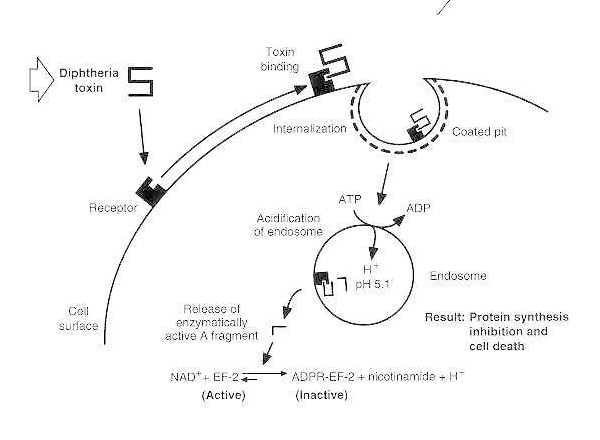
Skjematisk diagram av difteriforgiftning av en mottakelig eukaryot celle.
Toksinet binder seg til celleoverflatereseptoren og internaliseres via reseptormediert endocytose; ved forsuring av endosomet settes transmembrandomenet inn i vesikkelmembranen; det katalytiske domenet leveres til cytosolen, noe som fører til hemming av proteinsyntese og celledød.
Epidemiologi
Før masseimmunisering av den amerikanske befolkningen med difteritoksoid var difteri vanligvis en barnesykdom. Et bemerkelsesverdig aspekt ved masseimmunisering med difteritoksoid er at etter hvert som andelen av befolkningen med beskyttende nivåer av antitoksinimmunitet (≥ 0,01 IE/ml) øker, reduseres hyppigheten av isolering av toksigene stammer fra befolkningen. I dag, i USA, hvor klinisk difteri nesten fullstendig har forsvunnet, er isolering av toksigene stammer av C. diphtheriae sjelden. Fordi subklinisk infeksjon ikke lenger gir en kilde til eksponering for difteriantigen, og med mindre den forsterkes, avtar immuniteten mot antitoksin, har en stor andel voksne (30 til 60 %) antitoksinnivåer under beskyttende nivåer og er i faresonen. I USA, Europa og Øst-Europa har nylige utbrudd av difteri hovedsakelig forekommet blant personer som misbruker alkohol og/eller narkotika. Innenfor denne gruppen har bærere av toksigen C. diphtheriae et moderat høyt nivå av antitoksisk immunitet. Den nylige sammenbruddet av folkehelsetiltak i Russland har ført til at difteri har blitt en epidemi. Ved utgangen av 1994 var det rapportert mer enn 80 000 tilfeller og mer enn 2000 dødsfall i Russland.
Fokale utbrudd av difteri er nesten alltid assosiert med en immunbærer som har returnert fra en region der difteri er endemisk. Faktisk har nylige utbrudd av klinisk difteri i USA og Europa vært assosiert med reisende som returnerer fra Russland og Øst-Europa. Toksigene stammer av C. diphtheriae overføres direkte fra person til person via luftbårne dråper. Det er kjent at toksogene stammer kan kolonisere nasofaryngealt hulrom direkte. I tillegg kan det toksogene genet spres indirekte ved frigjøring av toksigen korynebakteriofag og lysogen transformasjon av ikke-toksigen autokton C. diphtheriae in situ. [ 5 ]
I tillegg til biotype- og lysotypebestemmelse av C. diphtheriae-isolater, kan molekylærbiologiske teknikker nå brukes til å studere difteriutbrudd. Restriksjonsendonukleasefordøyelsesmønstre av C. diphtheriae kromosomalt DNA har blitt brukt til å studere kliniske utbrudd, i likhet med bruk av klonede korynebakterielle innsettingssekvenser som en genetisk probe.
Schick-testen har blitt brukt i mange år for å vurdere immunitet mot difteritoksin, selv om den nå i mange områder er erstattet av den serologiske testen for spesifikke antistoffer mot difteritoksin. I Schick-testen injiseres en liten mengde difteritoksin (omtrent 0,8 ng i 0,2 ml) intradermalt i underarmen (teststedet) og 0,0124 μg difteritoksin i 0,2 ml injiseres intradermalt i kontrollstedet. Målinger tas etter 48 og 96 timer. Uspesifikke hudreaksjoner når vanligvis en topp etter 48 timer. Etter 96 timer indikerer en erytematøs reaksjon med mulig nekrose på teststedet utilstrekkelig antitoksisk immunitet til å nøytralisere toksinet (≤ 0,03 IE/ml). Betennelse i både test- og kontrollområdet etter 48 timer indikerer en overfølsomhetsreaksjon på antigenpreparatet.
Skjemaer
Corynebacterium diphtheriae infiserer nesesvelget eller huden. Toksigene stammer produserer et kraftig eksotoksin som kan forårsake difteri. Symptomer på difteri inkluderer faryngitt, feber og hevelse i nakken eller området rundt hudlesjonen. Difteritiske lesjoner er dekket av en pseudomembran. Toksinet sprer seg gjennom blodbanen til fjerne organer og kan forårsake lammelse og hjertesvikt. [ 6 ]
Det finnes to typer klinisk difteri: nasofaryngeal og kutan. Symptomer på faryngeal difteri varierer fra mild faryngitt til hypoksi på grunn av luftveisobstruksjon av en pseudomembran. Affeksjon av cervikale lymfeknuter kan forårsake alvorlig hevelse i nakken (oksnakkedifteri), og pasienten kan utvikle feber (≥ 103°F). Hudlesjoner ved kutan difteri er vanligvis dekket av en gråbrun pseudomembran. Livstruende systemiske komplikasjoner, hovedsakelig tap av motorisk funksjon (f.eks. svelgevansker) og hjertesvikt, kan utvikle seg som et resultat av virkningen av difteritoksin på perifere motoriske nevroner og myokardiet.
Kontroll
Kontroll av difteri avhenger av tilstrekkelig immunisering med difteritoksoid: difteritoksin inaktivert av formaldehyd, som forblir antigenisk intakt. Toksoidet fremstilles ved å inkubere difteritoksin med formaldehyd ved 37 °C under alkaliske forhold. Difteriimmunisering bør starte i den andre levemåneden med en serie på tre primærdoser med 4- til 8-ukers intervaller, etterfulgt av en fjerde dose omtrent 1 år etter den siste primærdosen. Difteritoksoid er mye brukt som en komponent i difteri-kikhoste-stivkrampe (DPT)-vaksinen. Epidemiologiske studier har vist at immunisering mot difteri er omtrent 97 % effektiv. Selv om masseimmunisering mot difteri praktiseres i USA og Europa, og barnevaksinasjonsratene er tilstrekkelige, kan en stor andel av den voksne befolkningen ha antistofftitre under beskyttelsesnivåene. Voksne bør revaksineres med difteritoksoid hvert 10. år. Faktisk bør en boosterimmunisering med difteri-tetanus-toksoid gis til reisende til områder med høy forekomst av endemisk difteri (Sentral- og Sør-Amerika, Afrika, Asia, Russland og Øst-Europa). I de senere år har bruken av høyrensede toksoidpreparater for immunisering minimert sporadiske alvorlige overfølsomhetsreaksjoner. En boosterimmunisering med difteri-tetanus-toksoid bør gis til reisende til områder med høy forekomst av endemisk difteri (Sentral- og Sør-Amerika, Afrika, Asia, Russland og Øst-Europa). I de senere år har bruken av høyrensede toksoidpreparater for immunisering minimert sporadiske alvorlige overfølsomhetsreaksjoner. Boosterimmunisering med difteri-tetanus-toksoid bør gis til reisende til områder med høy forekomst av endemisk difteri (Sentral- og Sør-Amerika, Afrika, Asia, Russland og Øst-Europa). I de senere år har bruken av høyrensede toksoidpreparater for immunisering minimert sporadiske alvorlige overfølsomhetsreaksjoner.
Selv om antibiotika (som penicillin og erytromycin) brukes som en del av behandlingen av pasienter med difteri, er rask passiv immunisering med difteri-antitoksin mest effektiv for å redusere dødelighet. Den lange halveringstiden til spesifikt antitoksin i blodet er en viktig faktor for å sikre effektiv nøytralisering av difteri-toksin. For å være effektivt må imidlertid antitoksinet reagere med toksinet før det kan komme inn i cellen.
Reengineering av difteritoksin for utvikling av eukaryote reseptorspesifikke cytotoksiner
Proteinteknikk er et nytt og raskt utviklende felt innen molekylærbiologi. Det kombinerer rekombinant DNA-metodikk og fastfase-DNA-syntese for å designe og konstruere kimære gener hvis produkter har unike egenskaper. Studier av struktur-funksjonsforholdene til difteritoksin har tydelig vist at dette toksinet er et protein med tre domener: katalytisk, transmembran og reseptor. Det har vært mulig å genetisk erstatte det native reseptorbindende domenet til difteritoksin med forskjellige polypeptidhormoner og cytokiner (f.eks. α-melanocyttstimulerende hormon [α-MSH], interleukin (IL) 2, IL-4, IL-6, IL-7, epidermal vekstfaktor). De resulterende kimære proteinene eller fusjonstoksinene kombinerer reseptorbindende spesifisitet til cytokinet med transmembran- og katalytiske domener til toksinet. I hvert tilfelle ble det vist at fusjonstoksinene selektivt forgifter bare de cellene som bærer den tilsvarende målreseptoren. Det første av disse genetisk modifiserte fusjonstoksinene, DAB 389IL-2, evalueres for tiden i kliniske studier på mennesker for behandling av refraktære lymfomer og autoimmune sykdommer der celler med IL-2-reseptorer med høy affinitet spiller en viktig rolle i patogenesen.[ 7 ] Administrasjon av DAB 389 IL-2 viste seg å være trygt, godt tolerert og i stand til å indusere varig sykdomsremisjon uten alvorlige bivirkninger. Det er sannsynlig at difteritoksinbaserte fusjonstoksiner vil bli viktige nye biologiske midler for behandling av spesifikke svulster eller sykdommer der spesifikke celleoverflatereseptorer kan målrettes.


 [
[