Medisinsk ekspert av artikkelen
Nye publikasjoner
Medisiner
Nevroleptika eller antipsykotika
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Antipsykotika (nevroleptika) er en klasse psykotrope legemidler som primært brukes til å behandle schizofreni. For tiden er det vanlig å skille mellom to grupper (eller kategorier) av legemidler: typiske og atypiske antipsykotika. Nedenfor finner du informasjon om farmakologiske egenskaper, indikasjoner for bruk og bivirkninger av behandlingen for hver av disse legemiddelgruppene.
Indikasjoner for bruk av typiske antipsykotika
For tiden inkluderer de viktigste indikasjonene for forskrivning av tradisjonelle nevroleptika, ifølge anbefalinger gitt av autoritative forskere innen psykofarmakaterapi, følgende.
- Lindring av psykomotorisk agitasjon og atferdsforstyrrelser forårsaket av alvorlige psykotiske symptomer. I disse tilfellene er bruk av orale eller parenterale former for legemidler med antipsykotisk effekt indisert, både globale (klopromazin, levomepromazin, tioproperazin, zuklopentiksol) og selektive - i form av en effekt på hallusinatorisk-paranoide lidelser (haloperidol, trifluoperazin).
- Anti-tilbakefall (forebyggende) terapi. For dette formålet foreskrives depotformer av legemidler, spesielt hos pasienter med dårlig etterlevelse av legemidlet (haloperidoldekanoat, forlenget form av flupentiksol), eller små eller mellomstore doser av legemidler for å oppnå en desinhibitorisk (antinegativ) effekt, blant de legemidlene hvis høye doser brukes til å lindre akutte psykotiske lidelser (flupentiksol, zuklopentiksol). I denne typen terapi anbefales det også å foreskrive såkalte små nevroleptika (tioridazin, klorprotiksen, sulpirid), hvis psykotrope aktivitet består i en effekt på manifestasjonene av den depressive polen og søvnforstyrrelser.
- Overvinne terapeutisk resistens mot atypiske antipsykotika i behandlingen av akutte psykotiske tilstander. For dette formålet brukes vanligvis parenterale former for tradisjonelle antipsykotika med global (klorpromazin, levomepromazin, etc.) og selektiv (haloperidol) antipsykotisk effekt.
Disse legemidlene forårsaker ulike bivirkninger, hvis natur avhenger av egenskapene til den farmakologiske profilen til hvert legemiddel. Antipsykotika med en mer uttalt kolinolytisk effekt forårsaker oftere akkommodasjonsforstyrrelser, forstoppelse, munntørrhet og urinretensjon. En beroligende effekt er mer typisk for antipsykotika med en uttalt antihistamineffekt, og ortostatisk hypotensjon er mer typisk for legemidler som blokkerer a1-adrenerge reseptorer. Blokkering av kolinerg, nordrenerg og dopaminerg overføring av typiske nevroleptika kan føre til en rekke lidelser i den seksuelle sfæren, som amenoré eller dysmenoré, anorgasmi, galaktoré, hevelse og ømhet i brystkjertlene og redusert potens. Bivirkninger i den seksuelle sfæren er hovedsakelig forbundet med de kolinolytiske og adrenoblokkerende egenskapene til disse legemidlene, og også med en økning i prolaktinsekresjon på grunn av blokkering av dopaminmetabolismen. De mest alvorlige bivirkningene av typiske nevroleptika er motorisk dysfunksjon. De er den vanligste årsaken til at pasienter slutter å ta medisiner. De tre viktigste bivirkningene av behandlingen assosiert med påvirkning av den motoriske sfæren inkluderer tidlige ekstrapyramidale syndromer, tardiv dyskinesi og malignt neuromuskulært syndrom.
Ekstrapyramidale syndromer antas å være assosiert med blokade av D2-reseptorer i basalgangliene. Disse inkluderer dystoni, nevroleptisk parkinsonisme og akatisi. Manifestasjoner av akutt dystonisk reaksjon (tidlig dyskinesi) inkluderer plutselig utviklende hyperkinesi, okulogyriske kriser, sammentrekninger av ansikts- og overkroppsmusklene, og opistotonus. Disse lidelsene er doseavhengige og oppstår ofte etter 2–5 dagers behandling med svært potente nevroleptika som haloperidol og flufenazin. For å lindre tidlig dyskinesi reduseres den nevroleptiske dosen og antikolinerge legemidler (biperiden, triheksyfenidyl) foreskrives. Tardiv dyskinesi involverer vanligvis nakkemusklene og, i motsetning til akutt dystonisk reaksjon, er mindre responsiv på behandling med antikolinergika. Nevroleptisk parkinsonisme er preget av redusert spontan motorikk, hypo- og amimi, hviletremor og rigiditet. Det er viktig å skille disse symptomene fra de tilsynelatende lignende negative lidelsene ved schizofreni, som er representert ved emosjonell fremmedgjøring, affektdemping og anergi. For å korrigere disse bivirkningene er bruk av antikolinergika, en reduksjon i dosen av nevroleptika eller erstatning av dette med et atypisk antipsykotikum indisert. Akatisi manifesterer seg ved indre angst, manglende evne til å forbli på ett sted over lengre tid, og behovet for å stadig bevege armer eller ben. For å lindre dette brukes antikolinergika og sentrale betablokkere (propranolol).
Sen dyskinesi manifesterer seg ved ufrivillige bevegelser i enhver muskelgruppe, oftest musklene i tungen og munnen. Klinisk skilles det mellom en rekke former: dyskinesi i musklene i kinnene, tungen og munnen (periodiske sammentrekninger av tyggemusklene, noe som skaper inntrykk av en grimaserende person, tungen kan ufrivillig stikke ut av pasientens munn); tardiv dystoni og tardiv akatisi; (pasienten gjør koreoatetoide bevegelser i hodet, overkroppen, øvre og nedre lemmer). Denne formen for lidelse registreres hovedsakelig under langvarig behandling med tradisjonelle nevroleptika og oppdages hos omtrent 15–20 % av pasientene som tar dem som vedlikeholdsbehandling. Sannsynligvis er risikoen for å utvikle dyskinesisymptomer økt hos noen pasienter, siden noen av dem ble observert i klinikken for schizofreni allerede før den "nevroleptiske æraen". I tillegg er tardiv dyskinesi beskrevet hos eldre kvinner og pasienter med affektive lidelser. Tardiv dyskinesi antas å være assosiert med en økning i antall dopaminreseptorer i striatum, selv om GABAerge og andre nevrotransmittersystemer sannsynligvis også er involvert i patogenesen. Det finnes ingen effektiv universell behandling for slike bivirkninger. Det antydes at lave doser av høypotente nevroleptika med dopaminblokkerende virkning eller vitamin E kan ha en moderat gunstig effekt ved disse lidelsene. Det mest effektive tiltaket for tardiv dyskinesi er en reduksjon i dosen av et typisk nevroleptikum eller erstatning av det med et atypisk antipsykotikum.
I følge nåværende data forekommer nevroleptisk malignt syndrom i omtrent 0,5 % av tilfellene med psykofarmakoterapi. Sannsynligvis kan den sjeldne forekomsten av en slik livstruende komplikasjon i dag forklares med den utbredte introduksjonen av atypiske antipsykotika i praksis, siden risikoen for å utvikle nevroleptika (NMS) under behandling med disse legemidlene er ubetydelig. Det er generelt akseptert at hovedårsaken til utvikling av NMS er overdreven blokade av det dopaminerge systemet under behandling med nevroleptika, spesielt etter økning av dosen av et svært potent antipsykotikum. Hovedsymptomene på NMS er hypertermi, økt tonus i skjelettmuskulatur og senereflekser, nedsatt bevissthet med overgang til koma. Blodprøver viser leukocytose, økt erytrocyttsedimentasjonsrate, levertransaminaseaktivitet; urinprøver viser tilstedeværelse av albuminuri. Vann- og elektrolyttbalanseforstyrrelser oppstår raskt, noe som skaper forutsetninger for dannelse av hjerneødem. NMS er en akutt tilstand som krever øyeblikkelig sykehusinnleggelse av pasienten for intensiv infusjonsbehandling. Ved behandling av NMS er hydrering og symptomatisk behandling viktigst. I denne situasjonen krever eventuelle foreskrevne nevroleptika øyeblikkelig seponering. I noen tilfeller har dopaminreseptoragonister (for eksempel bromokriptin) eller muskelavslappende midler en positiv effekt, selv om effektiviteten deres ikke er undersøkt. Etter eliminering av NMS bør nevroleptika ikke gjenopptas i minst to uker. Deretter kan et lavpotent antipsykotikum foreskrives, helst et legemiddel av ny generasjon. Dosen av det nylig foreskrevne legemidlet bør økes ekstremt nøye, samtidig som tilstanden til vitale funksjoner og laboratoriedata (blod- og urinprøver) overvåkes.
Typiske nevroleptika forårsaker sjelden farlige, fatale komplikasjoner. Overdosemanifestasjoner er hovedsakelig relatert til den individuelle profilen av legemidlets antiadrenerge og antikolinerge virkning. Siden disse legemidlene har en sterk antiemetisk effekt, er mageskylling indisert for eliminering fra kroppen, snarere enn administrering av brekkmidler. Arteriell hypotensjon er som regel en konsekvens av adrenerg reseptorblokade, og den bør korrigeres ved administrering av dopamin og noradrenalin. Ved hjertearytmi er bruk av lidokain indisert.
Virkningsmekanisme og farmakologiske effekter av typiske antipsykotika
Etter hvert som psykofarmakologien utviklet seg, ble det foreslått ulike alternativer for effekten av antipsykotika på nevroreseptorer. Hovedhypotesen er fortsatt at de påvirker dopamin-nevrostrukturer (primært D2-reseptorer), basert på data om forstyrrelse av normal dopaminmetabolisme i hjernestrukturer ved psykoser. Dopamin D2-reseptorer er lokalisert i basalgangliene, nucleus accumbens og frontal cortex; de spiller en ledende rolle i å regulere informasjonsflyten mellom hjernebarken og thalamus.
Figuren viser en mer detaljert forståelse av forstyrrelsene i dopaminoverføring i hjernens kortikale og subkortikale områder og hvilken rolle disse forstyrrelsene spiller i utviklingen av schizofrenisymptomer (tilpasset fra monografien av Jones RB, Buckley PF, 2006).
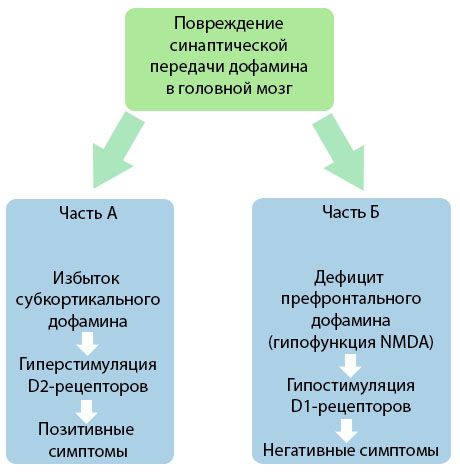
Del A gjenspeiler den klassiske, tidlige dopaminteorien, som postulerer et overskudd av dopamin i subkortikale områder og hyperstimulering av D2-reseptorer, noe som fører til fremveksten av produktive symptomer. Del B demonstrerer den påfølgende moderniseringen av teorien tidlig på 1990-tallet. Dataene som ble innhentet på dette tidspunktet, viste at en mangel på dopamin i D2-reseptorer, sammen med utilstrekkelig stimulering av disse reseptorene i prefrontal cortex, fører til fremveksten av negative symptomer og kognitive underskudd. Derfor, i henhold til moderne forståelse, er begge typer dopaminerge transmisjonsforstyrrelser - et overskudd av subkortikal dopamin og dets mangel i prefrontal cortex - det kombinerte resultatet av en forstyrrelse av synaptisk transmisjon i prefrontalområdet og er assosiert med N-metyl-N-aspartat-hypofunksjon. I tillegg til den initialt isolerte dopaminen, ble andre nevrotransmittere involvert i patogenesen av schizofreni senere identifisert, som serotonin, gamma-aminosmørsyre, glutamat, noradrenalin, acetylkolin og forskjellige nevropeptider. Selv om rollen til disse mediatorene ikke er fullt ut studert, blir det likevel, etter hvert som kunnskapen utvikler seg, klart at manifestasjonen av en rekke nevrokjemiske endringer i kroppen. Derfor er den kliniske effekten av et antipsykotisk legemiddel en oppsummering av effektene på ulike reseptorformasjoner og fører til eliminering av homeostaseforstyrrelser.
I de senere år, på grunn av fremveksten av nye forskningsmetoder som radioisotopligandbinding og PET-skanning, har det blitt gjort betydelige fremskritt i å belyse den fine biokjemiske virkningsmekanismen til nevroleptika. Spesielt har den komparative styrken og tropismen til legemidler når det gjelder å binde seg til individuelle nevroreseptorer i ulike områder og strukturer i hjernen blitt bestemt. En direkte avhengighet av alvorlighetsgraden av den antipsykotiske effekten av et legemiddel av styrken av dets blokkerende effekt på ulike dopaminerge reseptorer har blitt vist. Nylig har fire typer slike reseptorer blitt identifisert:
- D1 er hovedsakelig lokalisert i området rundt substantia nigra og striatum (den såkalte nigrostriatale regionen), samt den prefrontale regionen;
- D2 - i nigrostriatale, mesolimbiske regioner og den fremre hypofysen (sekresjon av prolaktin);
- D3 (presynaptisk) - i ulike hjernestrukturer, kontrollerer dopaminerg aktivitet i henhold til loven om negativ tilbakemelding;
- D4 (presynaptisk) - hovedsakelig i nigrostriatale og mesolimbiske områder.
Samtidig kan det nå anses som bevist at det er blokkeringen av D2-reseptorer som forårsaker utviklingen av antipsykotiske, sekundære beroligende effekter, samt ekstrapyramidale bivirkninger. Andre kliniske manifestasjoner av blokkeringen av denne typen reseptorer er den smertestillende og antiemetiske effekten av nevroleptika (reduksjon av kvalme, oppkast som følge av undertrykkelse av oppkastsenteret), samt en reduksjon i innholdet av veksthormon og en økning i produksjonen av prolaktin (nevroendokrine bivirkninger, inkludert galaktoré og menstruasjonsuregelmessigheter). Langvarig blokade av nigrostriatale D2-reseptorer fører til forekomsten av deres hypersensitivitet, som er ansvarlig for utviklingen av tardive dyskinesier og "hypersensitivitetspsykoser". Sannsynlige kliniske manifestasjoner av blokaden av presynaptiske D3- og D4-reseptorer er hovedsakelig assosiert med den stimulerende effekten av nevroleptika. På grunn av den delvise blokkeringen av disse reseptorene i nigrostriatale og mesolimbokortikale områder, kan aktiverende og insisive (kraftige, svært aktive) nevroleptika i små doser stimulere, og i høye doser undertrykke, dopaminerg overføring.
I de senere år har interessen for funksjonen til de serotonerge systemene i hjernen, inkludert serotoninreseptorer, økt kraftig. Faktum er at det serotonerge systemet har en modulerende effekt på dopaminerge strukturer i ulike deler av hjernen. Spesielt i den mesokortikale regionen hemmer serotonin frigjøringen av dopamin, og følgelig fører blokkeringen av postsynaptiske 5-HT-reseptorer til en økning i dopamininnholdet. Som kjent er utviklingen av negative symptomer ved schizofreni assosiert med hypofunksjon av dopaminneuroner i de prefrontale strukturene i hjernebarken. For tiden er omtrent 15 typer sentrale 5-HT-reseptorer kjent. Det har blitt eksperimentelt oppdaget at nevroleptika hovedsakelig binder seg til 5-HT-reseptorer av de tre første typene.
Disse legemidlene har hovedsakelig en stimulerende (agonistisk) effekt på 5-HT1a-reseptorer. Sannsynlige kliniske konsekvenser: økt antipsykotisk aktivitet, redusert alvorlighetsgrad av kognitive forstyrrelser, korrigering av negative symptomer, antidepressiv effekt og redusert forekomst av ekstrapyramidale bivirkninger.
Effekten av nevroleptika på 5-HT2-reseptorer, spesielt på 5-HT2a-subtyper, er av betydelig betydning. De er hovedsakelig lokalisert i hjernebarken, og følsomheten deres er økt hos pasienter med schizofreni. Evnen til ny generasjons nevroleptika til å redusere alvorlighetsgraden av negative symptomer, forbedre kognitive funksjoner, regulere søvn ved å øke den totale varigheten av langsomme bølger (D-bølge) søvnfaser, redusere aggresjon og lindre depressive symptomer og migrenelignende (som følge av cerebrovaskulære lidelser) hodepine er assosiert med blokaden av 5-HT2a-reseptorer. På den annen side, med blokaden av 5-HT2a-reseptorer, er hypotensive effekter og ejakulasjonsforstyrrelser hos menn mulige.
Det antas at effekten av nevroleptika på 5-HT2c-reseptorer forårsaker en beroligende (angstdempende) effekt, økt appetitt (ledsaget av en økning i kroppsvekt) og en reduksjon i prolaktinproduksjon.
5-HT3-reseptorer er hovedsakelig lokalisert i den limbiske regionen, og når de blokkeres, utvikles den antiemetiske effekten først, og de antipsykotiske og angstdempende effektene forsterkes også.
Forekomsten av Parkinsonisme-lignende symptomer avhenger også av legemidlets blokkerende kraft på muskariniske kolinerge reseptorer. Kolinolytiske og dopaminblokkerende effekter er til en viss grad i gjensidige forhold. Det er for eksempel kjent at D2-reseptorer i nigrostriatalregionen hemmer frigjøringen av acetylkolin. Når mer enn 75 % av D2-reseptorene i nigrostriatalregionen er blokkert, forstyrres balansen til fordel for det kolinerge systemet. Dette er årsaken til den korrigerende effekten av antikolinerge legemidler (korrektorer) på nevroleptiske ekstrapyramidale bivirkninger. Klorprotixen, klozapin og olanzapin har høy affinitet for muskariniske reseptorer og forårsaker praktisk talt ikke ekstrapyramidale bivirkninger, siden de blokkerer kolinerge og dopaminerge reseptorer samtidig. Haloperidol og piperazin-fenotiazinderivater har en uttalt effekt på dopaminreseptorer, men har en svært svak effekt på kolinreseptorer. Dette skyldes deres evne til å forårsake uttalte ekstrapyramidale bivirkninger, som reduseres ved bruk av svært høye doser, når den kolinolytiske effekten blir merkbar. I tillegg til å redusere den dopaminblokkerende effekten på D2-reseptorer i nigrostriatalregionen og utjevne ekstrapyramidale bivirkninger, kan en sterk kolinerg effekt forårsake forverring av kognitive funksjoner, inkludert hukommelsesforstyrrelser, samt perifere bivirkninger (tørre slimhinner, nedsatt synsinntak, forstoppelse, urinretensjon, forvirring, etc.). Nevroleptika har en ganske sterk blokkerende effekt på type I histaminreseptorer, som først og fremst er assosiert med alvorlighetsgraden av den beroligende effekten, samt en økning i kroppsvekt på grunn av økt appetitt. De antiallergiske og kløestillende effektene av nevroleptika er også assosiert med deres antihistaminegenskaper.
I tillegg til dopaminblokkering, antiserotonerg, kolinolytisk og antihistamineffekt, har de fleste nevroleptika adrenolytiske egenskaper, dvs. at de blokkerer både sentrale og perifere a1-adrenoreseptorer. Adrenoblokkere som klorpromazin og klorprotiksen har en uttalt sedativ effekt. I tillegg kan den blokkerende effekten av disse legemidlene forårsake nevrovegetative bivirkninger (arteriell hypotensjon, takykardi, etc.), samt en økning i den hypotensive effekten av adrenoblokkere.
Arbeidene til et stort antall forfattere gir data om bindingsstyrken (affiniteten) til individuelle nevroleptika med forskjellige typer nevroreseptorer.
Basert på deres nevrokjemiske virkningsprofil kan typiske og atypiske antipsykotika, blant de som hovedsakelig brukes i klinisk praksis, betinget deles inn i seks grupper.
Den første gruppen består av selektive blokkere av D2- og D4-reseptorer (sulpirid, amisudprid, haloperidol, etc.) fra gruppene benzamid- og butyrofenonderivater. I små doser, hovedsakelig på grunn av blokkering av presynaptiske D4-reseptorer, aktiverer de dopaminerg overføring av nerveimpulser og har en stimulerende (disinhibitorisk) effekt, i store doser blokkerer de D2-reseptorer i alle områder av hjernen, noe som klinisk manifesteres av en uttalt antipsykotisk effekt, samt ekstrapyramidale og endokrine (på grunn av prolaktinemi) bivirkninger.
Den andre gruppen omfatter svært aktive D2-reseptorblokkere, samt legemidler som svakt eller moderat blokkerer 5-HT2a- og 5-HT1a-reseptorer (flupentiksol, flufenazin, zuklopentiksol, etc.), dvs. hovedsakelig piperazinderivater av fenotiazin eller tioxantener som er nær dem i stereokjemisk struktur. I likhet med legemidlene i den første gruppen har disse nevroleptikaene først og fremst en uttalt antipsykotisk (skarp) effekt, og forårsaker også ekstrapyramidale pye-effekter og prolaktinemi. I små doser har de en moderat aktiverende (psykostimulerende) effekt.
Den tredje gruppen består av polyvalente beroligende nevroleptika som blokkerer de fleste nevroreseptorer på en udifferensiert måte. Disse legemidlene har en tydelig uttrykt blokkerende effekt på dopaminreseptorer og forårsaker også sterke adrenolytiske og kolinolytiske effekter. Dette inkluderer de fleste beroligende nevroleptika, primært alifatiske og piperidinderivater av fenotiazin, samt tioxantener som er nær dem i stereokjemisk struktur (klorpromazin, levomepromazin, klorprotixen, etc.). Spekteret av psykotrop aktivitet til disse legemidlene domineres først og fremst av en uttalt primær beroligende effekt, som utvikles uavhengig av hvilken dose som brukes, og en moderat antipsykotisk effekt. I tillegg, på grunn av deres uttalte antikolinerge effekt, forårsaker legemidler i denne gruppen svake eller moderate ekstrapyramidale og nevroendokrine bivirkninger, men fører ofte til utvikling av ortostatisk hypotensjon og andre autonome reaksjoner på grunn av uttalt blokade av a1-adrenerge reseptorer.
Den fjerde gruppen omfatter nevroleptika som blokkerer D2- og 5-HT2a-reseptorer på en balansert måte, dvs. i samme grad (sistnevnte i litt større grad) og a1-adrenoreseptorer i moderat grad. Denne gruppen omfatter representanter for den nye generasjonen atypiske antipsykotika (risperidon, ziprasidon, sertindol), som har forskjellige kjemiske strukturer. Den nevrokjemiske virkningsmekanismen bestemmer deres selektive innflytelse primært på de mesolimbiske og mesokortikale områdene i hjernen. Sammen med en tydelig antipsykotisk effekt, fravær eller svak forekomst av ekstrapyramidale bivirkninger (ved bruk av terapeutiske doser), svak eller moderat prolaktinemi og moderate adrenolytiske egenskaper (hypotensive reaksjoner), er denne gruppen nevroleptika i stand til å korrigere negative symptomer ved indirekte stimulering av dopaminerg transmisjon i hjernebarken.
Den femte gruppen består av polyvalente atypiske antipsykotika med trisyklisk dibenzodiazepin eller lignende struktur (klozapin, olanzapin og quetiapin). Akkurat som legemidlene i den tredje gruppen blokkerer de de fleste nevroreseptorer på en udifferensiert måte. Imidlertid er 5-HT2a-reseptorer blokkert sterkere enn D2- og D4-reseptorer, spesielt de som befinner seg i nigrostriatalregionen. Dette bestemmer det faktiske fraværet eller svake ekstrapyramidale effekten og fraværet av nevroendokrine bivirkninger forbundet med økt prolaktinproduksjon med en tydelig antipsykotisk effekt og evnen til å redusere alvorlighetsgraden av negative symptomer. I tillegg har alle legemidler i denne gruppen uttalte adrenolytiske og antihistaminegenskaper, noe som bestemmer de beroligende og hypotensive effektene. Klozapin og olanzapin har også en ganske uttalt blokkerende effekt på muskarinreseptorer og fører til utvikling av kolinolytiske bivirkninger.
Dermed er evnen til å blokkere postsynaptiske dopaminerge reseptorer med en kompenserende økning i syntesen og metabolismen av dopamin den eneste felles biokjemiske egenskapen for alle nevroleptika som vurderes i disse gruppene.
Den sjette gruppen inkluderer det eneste atypiske antipsykotikumet, aripiprazol, som har dukket opp på det innenlandske psykofarmakamarkedet relativt nylig. Dette legemidlet er en delvis agonist av D2-dopaminreseptorer, og fungerer som en funksjonell antagonist i en hyperdopaminerg tilstand og som en funksjonell agonist i en hypodopaminerg profil. En slik unik reseptorprofil av aripiprazol gjør det mulig å redusere risikoen for ekstrapyramidale lidelser og hyperprolaktinemi ved bruk. I tillegg fungerer aripiprazol som en delvis agonist av 5-HT1a-reseptorer, og samtidig er det en antagonist av 5-HT2a-reseptorer. Det antas at slik interaksjon med reseptorer fører til en generelt balansert funksjon av serotonin- og dopaminsystemene, slik at virkningsmekanismen til aripiprazol kan betegnes som stabilisering av dopamin-serotoninsystemet.
Dermed lar dagens kunnskapsnivå om nevroleptikas nevrokjemiske virkningsmekanismer oss foreslå en ny, patogenetisk mer underbygget farmakodynamisk klassifisering av denne gruppen psykotrope legemidler. Bruken av denne klassifiseringen lar oss i stor grad forutsi spekteret av psykotrop aktivitet, toleranse og sannsynlige legemiddelinteraksjoner for et bestemt legemiddel. Med andre ord bestemmer egenskapene ved et legemiddels nevrokjemiske aktivitet i stor grad egenskapene ved dets kliniske aktivitet, som bør brukes når man velger et bestemt antipsykotisk legemiddel for en spesifikk pasient.
Effektiviteten av den globale antipsykotiske effekten av ethvert nevroleptikum estimeres ved hjelp av den såkalte klorpromazinekvivalenten, som tas som 1. For eksempel er klorpromazinekvivalenten av haloperidol = 50. Dette betyr at den antipsykotiske effekten av 1 mg haloperidol er sammenlignbar med 50 mg klorpromazin. Basert på denne indikatoren er det utviklet en klassifisering som gir mulighet for tildeling av nevroleptika med høy (klorpromazinekvivalent> 10,0), middels (klorpromazinekvivalent = 1,0-10,0) og lav (klorpromazinekvivalent = 1,0) antipsykotisk aktivitet, kalt patentitet. Typiske nevroleptika (første generasjons antipsykotika) har vært mye brukt i klinisk psykofarmakoterapi i nesten et halvt århundre. Spekteret av deres terapeutiske aktivitet inkluderer:
- global antipsykotisk virkning i form av evnen til å redusere ulike manifestasjoner av psykose jevnt og differensielt:
- primær beroligende (hemmende) effekt - medisiners evne til raskt å lindre psykomotorisk agitasjon;
- selektiv, selektiv antipsykotisk virkning, manifestert i evnen til å påvirke individuelle symptomer: delirium, hallusinasjoner, desinfisering av drifter, etc.;
- aktiverende (desinhibitorisk, desinhibitorisk, antiautistisk) nevrotropisk virkning, manifestert ved utvikling av ekstrapyramidale symptomer;
- somatotropisk virkning i form av utvikling av nevroendokrine og vegetative bivirkninger;
- depressiv effekt, uttrykt i evnen til noen antipsykotika til å forårsake depressive symptomer.
Effektiviteten til førstegenerasjons antipsykotika i behandlingen av ikke bare psykotiske lidelser, men også lidelser innen borderlinepsykiatri har blitt bevist mange ganger og er udiskutabel. Til tross for den høye hyppigheten av bivirkninger av behandling når de forskrives, fortsetter de derfor å bli brukt i medisinsk praksis.
Atypiske antipsykotika
Moderne retningslinjer inneholder data om fordelene ved å bruke andre generasjons antipsykotika i farmakoterapi. Begrepet «atypisk» (synonym - andre generasjons antipsykotika) er betinget og brukes hovedsakelig for å gjøre det lettere å betegne den nye generasjonen. Sammenlignet med tradisjonelle nevroleptika er legemidler i denne gruppen mer effektive i å korrigere negative, affektive og kognitive lidelser, noe som kombineres med bedre toleranse og lavere risiko for ekstrapyramidale symptomer. Forskjeller i den terapeutiske effekten av ett eller annet legemiddel fra en serie atypiske antipsykotika forklares, som i gruppen av typiske nevroleptika, av dets individuelle profil av farmakologisk virkning.
For å avklare mulighetene for psykofarmakaterapi med atypiske antipsykotika, er det tilrådelig å fokusere på legemidlene i denne gruppen som er registrert i Russland.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Klozapin (dibenzodiazepin)
Grunnleggeren av gruppen av atypiske antipsykotika. Virkningsmekanismen til klozapin er preget av en svak blokade av D2-reseptorer med samtidig høy antagonisme mot 5-HT2a-reseptorer, a1-, a2-adrenerge og H1-histaminreseptorer. Det har vist seg å være et effektivt antipsykotikum i tilfeller av resistens mot andre antipsykotika (et legemiddel i reservegruppen), og er også indisert for behandling av kronisk mani, psykotisk agitasjon og aggresjon. I hjemmepraksis foreskrives klozapin ofte for å oppnå sedasjon og som hypnotikum hos psykotiske pasienter. Det bør erkjennes at slik bruk av klozapin ikke samsvarer med hovedindikasjonsprofilen for bruk i terapi. Sannsynligvis bør holdningen til dette antipsykotikumet som et legemiddel av sekundær betydning revideres, siden det i dag er det eneste legemidlet med dokumentert effektivitet hos resistente pasienter.
I motsetning til typiske nevroleptika forårsaker ikke klozapin alvorlige ekstrapyramidale lidelser på grunn av den nevnte lave affiniteten til O2-reseptorer. Det viste seg også at det kan brukes til å behandle sen dystoni og alvorlig akatisi. På grunn av den lave risikoen for å utvikle malign nevroleptika (NMS), kan klozapin betraktes som et foretrukket legemiddel hos pasienter som tidligere har hatt denne komplikasjonen.
Imidlertid kan en rekke alvorlige bivirkninger utvikles under klozapinbehandling. Den farligste av dem (selv når små doser foreskrives) er agranulocytose, som forekommer hos 0,5–1,0 % av pasientene. Andre viktige bivirkninger som kan oppstå ved bruk av legemidlet inkluderer døsighet, hypersalivasjon og vektøkning, som ofte allerede er forhøyet når klozapin forskrives under påvirkning av tidligere antipsykotisk behandling. Man bør også være oppmerksom på muligheten for å utvikle takykardi, arteriell hypotensjon og epileptiske anfall ved bruk. Sannsynligheten for anfall avhenger av dosen. Risikoen øker betydelig hvis klozapindosen overstiger 600 mg/dag. Utvikling av anfall er ikke en kontraindikasjon for videre bruk av legemidlet, men krever en halvering av dosen og forskrivning av antikonvulsiva midler, som valproinsyre. Forebygging av bivirkninger av klozapinbehandling inkluderer nøye overvåking av antall hvite blodlegemer, samt EKG- og endokrine parametere.
Overdosering av klozapin kan forårsake bevissthetsdepresjon opp til utvikling av koma, samt symptomer forbundet med den kolinolytiske effekten (takykardi, delirium), epileptiske anfall, respirasjonsdepresjon, ekstrapyramidale syndromer. Dødelig utgang kan oppstå ved inntak av en dose som overstiger 2500 mg av legemidlet.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidon
Et benzisoksazolderivat med høy affinitet for serotonin- og dopamin Dj-reseptorer med en dominerende effekt på serotoninsystemet. Legemidlet har et bredt spekter av indikasjoner for bruk, inkludert lindring av eksaserbasjoner, behandling mot tilbakefall, terapi for den første psykotiske episoden og korrigering av negative symptomer på schizofreni. Legemidlet har vist seg å forbedre kognitiv funksjon hos pasienter med schizofreni. Foreløpige data er innhentet som viser at risperidon også reduserer komorbide affektive symptomer hos pasienter med schizofreni og kan være et foretrukket legemiddel i behandlingen av bipolare affektive lidelser.
Bivirkninger av risperidonbehandling, spesielt ekstrapyramidale lidelser, er doseavhengige og forekommer oftere ved doser over 6 mg/dag. Andre bivirkninger inkluderer kvalme, oppkast, angst, døsighet og økte serumprolaktinnivåer. Langvarig bruk av risperidon kan føre til vektøkning og utvikling av diabetes mellitus type 2, men med lavere sannsynlighet sammenlignet med klozapin og olanzapin.
Overdosering kan forårsake søvnighet, epileptiske anfall, forlengelse av QT-intervallet og utvidelse av QRS-komplekset, og arteriell hypotensjon. Tilfeller med dødelig utgang på grunn av overdosering av risperidon er beskrevet.
Den utvilsomme fordelen med legemidlet er tilgjengeligheten av flytende og hurtigoppløselige (sublinguale) former, hvis bruk akselererer legemidlets opptak i pasientens kropp og letter kontrollen over inntaket. Det finnes også en forlenget form av legemidlet - pulver til fremstilling av en suspensjon for intramuskulær administrering (consta-risperidon i mikrosfærer). Det anbefales for vedlikeholdsbehandling av pasienter med schizofreni, spesielt for pasienter med dårlig etterlevelse. Det er nødvendig å ta hensyn til det faktum at legemidlet trenger omtrent tre uker for å komme inn i blodomløpet, derfor må pasienten, når behandlingen med consta-risperidon startes, i tillegg ta oral form av risperidon i minst 3 uker etter den første injeksjonen.
Olanzapin
Når det gjelder farmakologisk virkning, er det nært klozapin, siden det har en pleiomorf reseptorprofil med betydelig affinitet for serotonin-, muskarin-, alfa1-adrenerge og histaminreseptorer. Den terapeutiske aktiviteten til olanzapin har trekk som ligner på effektiviteten til klozapin og risperidon når det gjelder effekten på positive, negative og depressive symptomer på schizofreni. Samtidig er det innhentet data om den større effektiviteten til olanzapin sammenlignet med andre atypiske antipsykotika hos pasienter med den første psykotiske episoden og i korrigering av kognitive funksjonsindikatorer. Det bør tas i betraktning at ved starten av behandlingen med tablettformen av legemidlet kan det oppstå en rask desinhibitorisk effekt med økt psykomotorisk agitasjon og angst. Derfor er bruk av injeksjonsformen av legemidlet indisert ved behandling av anfall ledsaget av alvorlig psykomotorisk agitasjon.
Olanzapin forårsaker sjelden ekstrapyramidale lidelser eller tardiv dyskinesi, og de vanligste bivirkningene ved bruk er metabolske forstyrrelser og vektøkning. Det er fastslått at pasienter som får olanzapin ofte opplever forhøyede nivåer av kolesterol, plasmalipider og en predisposisjon for diabetes mellitus type 2, men slike effekter var like vanlige hos pasienter som fikk både olanzapin og klozapin. Samtidig er det innhentet data som viser at vektøkning korrelerer med en positiv respons på olanzapin (dvs. fungerer som en viktig prognostisk indikator for behandling), og utvikler seg til fedme bare hos 20–30 % av pasientene som har gått opp i vekt under behandlingen.
Overdose kan forårsake sedasjon, toksiske antikolinerge effekter, epileptiske anfall og arteriell hypotensjon. Det finnes for øyeblikket ingen overbevisende data for å vurdere risikoen for død ved overdose.
Quetiapin
Det er klassifisert som en dibenzotiazepinforbindelse. Reseptorprofilen er i stor grad lik klozapins. Bindingsnivået av quetiapin til D2-reseptorer er lavt (mindre enn 50 %) og kortvarig, selv når høye doser brukes. Legemidlet er effektivt i behandlingen av positive, negative og generelle symptomer på schizofreni. Det finnes bevis for vellykket bruk både i tilfeller med høy resistens mot terapi og for å forbedre pasientenes kognitive funksjon, noe som gir rett til å anbefale det som et førstelinjeantipsykotikum for vedlikeholdsbehandling av schizofreni. Til slutt har quetiapin en moderat antidepressiv, aktiverende effekt. Derfor er det indisert i behandling av depressive-vrangforestillingsanfall og forstyrrelser i senesto-hypokondriakkretsen.
Den etablerte høye tymotropiske aktiviteten til quetiapin forklarer hvorfor det er registrert som et middel for lindring og sekundær forebygging av depressive lidelser. For behandling av maniske episoder ved bipolar lidelse type I og II brukes quetiapin som et tilleggsmiddel. Fraværet av injeksjonsformer begrenser bruken noe hos pasienter med agitasjon og aggressiv atferd.
Quetiapin tolereres godt, det forårsaker praktisk talt ikke ekstrapyramidale syndromer, bortsett fra i tilfeller der maksimale doser brukes. Quetiapin forårsaker ikke hyperprolaktinemi, sjeldnere enn olanzapin og klozapin, fører det til vektøkning og nedsatt glukosetoleranse.
Ziprasidon
Har en unik profil av reseptoraktivitet. Som en potent antagonist av 5HT2a-reseptorer og D2-reseptorer, er det også en aktiv hemmer av serotonin- og noradrenalinreopptak. Kliniske studier har vist betydelig overlegenhet av ziprasidon i dens effekt på psykotiske symptomer og manifestasjoner av aggresjon sammenlignet med haloperidol. Det finnes også data om den positive effekten av ziprasidon på de kognitive funksjonene hos pasienter med schizofreni, samt på komorbide affektive symptomer, indikatorer på sosial funksjon. Ziprasidon tolereres vanligvis godt og forårsaker svært sjelden ekstrapyramidale syndromer, vektøkning og metabolske forstyrrelser. Oftere er det en forlengelse av QT-intervallet over 460 ms, derfor anbefales det for pasienter som får dette legemidlet å gjennomgå en EKG-undersøkelse både før forskrivning av legemidlet og kontrollmonitorering under behandling. Spesiell oppmerksomhet bør rettes mot samtidig behandling (inntak av antiarytmika), som kan forverre forlengelsen av QT-intervallet og føre til utvikling av hjertearytmi, ventrikkelflimmer.
Sertindol
Tilhører derivater av fenylindol. Det har høy funksjonell antagonisme i forhold til D2-, serotonin- (spesielt 5-HT2a-reseptorer) og a1-adrenerge reseptorer. I følge elektroneurokjemiske studier hemmer sertindol selektivt dopaminreseptorer i den ventrale segmentregionen. Slik selektivitet sikrer sannsynligvis lav risiko for ekstrapyramidale syndromer og hyperprolaktinemi ved bruk av legemidlet. Resultatene fra sammenlignende studier har vist at sertindol er sammenlignbar med haloperidol når det gjelder antipsykotisk aktivitet. Legemidlet har en uttalt desinhibitorisk effekt hos pasienter med negative og depressive symptomer, som er bedre enn en lignende effekt av rispolept. Det finnes også bevis som bekrefter effektiviteten til sertindol for korrigering av kognitiv svikt hos pasienter med schizofreni. Sertindol tolereres generelt godt av pasienter, forårsaker sjelden sedasjon og anbefales derfor som erstatningslegemiddel når bivirkninger oppstår under behandling med andre moderne antipsykotika.
Alvorlige bivirkninger inkluderer legemidlets evne til å forlenge QT-intervallet, noe som kan føre til hjertearytmi. Ved analyse av studier etter markedsføring ble det klart at sertindols hjerteprofil ikke skiller seg fra andre antipsykotika av ny generasjon.
Aripiprazol
Det har antipsykotisk aktivitet som er sammenlignbar med andre atypiske midler, men har en større effekt på parametrene for kognitiv funksjon hos pasienter med schizofreni. Den ovennevnte unike farmakologiske virkningen av legemidlet - en partiell agonist av D2-reseptorer - gjør det mulig å redusere risikoen for ekstrapyramidale syndromer og hyperprolaktinemi ved bruk.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprid
Tilhører klassen av substituerte benzamider. Legemidlet binder seg selektivt til subtypene av D2- og D3-dopaminerge reseptorer, har ingen affinitet for subtypene D1, D4 og D5, samt for serotonin, H1-histamin, a1-adrenerge og kolinerge reseptorer. Ved bruk i høye doser blokkerer det postsynaptiske D2-reseptorer. I lave doser manifesterer den desinhibitoriske effekten seg på grunn av blokkering av presynaptiske D2- og D3-reseptorer, noe som gjør at bruken også er effektiv i behandlingen av negative symptomer, selv om det ikke er en kombinert antagonist av D2-reseptorer og serotoninreseptorer. Resultatene fra en rekke studier indikerer en uttalt antipsykotisk aktivitet av legemidlet ved bruk i høye doser, som er bedre enn tradisjonelle legemidler.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Bivirkninger av antipsykotisk behandling
Tabellen viser de viktigste bivirkningene av atypisk antipsykotisk behandling.
Preparat |
Ekstrapyramidale |
Ledningsforstyrrelse på EKG |
Metabolske forstyrrelser (vektøkning, økte nivåer av glukose, kolesterol, triglyserider i blodet) |
||
Klozapin |
. |
++ |
++ |
++- |
|
Risperidon |
++ |
+/- |
++ |
+/- |
|
Olanzapin |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapin |
+/- |
+ |
+/- |
--- |
|
Ziprasidon |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprid |
++ |
+/- |
|||
Merk. Alvorlighetsgrad av bivirkninger: "+++" - høy; "++" - gjennomsnittlig; "+" - lav; "+/-" - tvilsom; "-" - fraværende.
Ekstrapyramidale syndromer
Et av hovedtrekkene ved atypiske antipsykotika, i motsetning til tradisjonelle, er deres lave evne til å forårsake ekstrapyramidale syndromer, noe som ble et gjennombrudd i vedlikeholdsbehandlingen av schizofreni. Som det fremgår av dataene i tabellen, kan imidlertid slike symptomer oppstå ved bruk av individuelle legemidler i denne serien (risperidon, amisulprid), noe som krever spesiell oppmerksomhet ved forskrivning.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
EKG-avvik
Muligheten for å utvikle kardiale bivirkninger er et alvorlig problem ved bruk av noen moderne antipsykotika i terapi. I disse tilfellene snakker vi om forlengelse av QT-intervallet, noe som kan føre til utvikling av arytmi. Ledningsforstyrrelser, primært forlengelse av QT-intervallet, observeres oftest under behandling med klozapin, sertindol og ziprasidon. Samtidig patologi i form av bradykardi, atrioventrikulær blokk og hypotyreose kan bidra til forekomsten av denne komplikasjonen under behandling med de ovennevnte legemidlene. For tiden anbefales EKG-monitorering omtrent hver tredje måned hos pasienter som får vedlikeholdsbehandling med atypiske antipsykotika.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Endokrine lidelser
For tiden er den største bekymringen atypiske antipsykotiske legemidlenes evne til å forårsake vektøkning. Økt kroppsvekt, glukose- og triglyseridnivåer i blodet kan føre til metabolske forstyrrelser og utvikling av type 2 diabetes. Spesiell forsiktighet og ukentlig overvåking av biokjemiske parametere er nødvendig under behandling med klozapin og olanzapin. I følge J. Geddes et al. (2000), PB Jones, PF Buckley (2006) bør det anerkjennes som hensiktsmessig å gjennomføre en grundig undersøkelse av pasienter før de forskriver et bestemt antipsykotikum av den moderne generasjonen, siden det er kjent at metabolske forstyrrelser oftere forekommer hos pasienter som hadde en arvelig predisposisjon, overvekt, lipidspektrumforstyrrelser og hyperglykemi før behandlingsstart. Overvåkingsalgoritmen foreslått av PB Jones, PF Buckley (2006) inkluderer flere punkter.
- Innsamling av sykehistorie og familiefaktorer angående risiko for metabolske forstyrrelser.
- Registrering av kroppsmasseindeks, EKG, blodtrykk og puls før behandlingsstart.
- Innsamling av laboratoriedata (glukose, lipidprofil, kolesterol) før behandlingsstart.
- Regelmessig overvåking av kroppsmasseindeks og vitale tegn under behandlingen.
- Overvåking av laboratoriedata under behandling.
Forekomsten av hyperprolaktinemi under antipsykotisk behandling skyldes sentral blokade av dopaminreseptorer i hypothalamus, noe som fører til frigjøring av prolaktin fra den fremre hypofysen. Hyperprolaktinemi forekommer oftest ved behandling med olanzapin, risperidon og amisulprid.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocytose
En annen alvorlig komplikasjon ved antipsykotisk behandling. Den kan observeres under behandling med klozapin og olanzapin. Ifølge J. Geddes et al. (2000) ble den diagnostisert i løpet av de første 3 månedene hos 1-2 % av pasientene som tar disse legemidlene. I denne forbindelse anbefales ukentlige blodprøver for pasienter som tar disse legemidlene i løpet av de første 18 ukene av behandlingen, og deretter månedlig overvåking. Det har blitt vist at når dosen av de ovennevnte nevroleptika reduseres, går den kliniske blodprøven tilbake til normalen. Samtidig bør det erkjennes at det per dags dato ikke finnes noen klar strategi for pasienter som opplever de ovennevnte bivirkningene forbundet med metabolske forstyrrelser. Oftest erstattes ett atypisk antipsykotikum med et annet. En annen lovende retning er utnevnelse av spesiell korrigerende terapi, spesielt bruk av bromokriptin for å korrigere hyperprolaktinemi. Den ideelle situasjonen er en der behandlingen av en pasient med slike lidelser utføres med periodisk involvering av indreleger, spesielt endokrinologer, kardiologer og andre spesialister.
Avslutningsvis bør det bemerkes at dersom de gitte algoritmene for forskrivning og overvåking av ikke bare pasientenes mentale, men også den fysiske tilstanden følges, er bruk av andre generasjons legemidler tryggere enn typiske nevroleptika.
En rekke andre antipsykotika er for tiden i utviklingsfasen. Neste generasjons legemidler vil sannsynligvis ha en annen virkningsmekanisme (for eksempel en GABAergisk profil) og vil kunne påvirke ulike manifestasjoner av schizofreni, inkludert selve underskuddslidelsen.
Oppmerksomhet!
For å forenkle oppfatningen av informasjon, blir denne instruksjonen for bruk av stoffet "Nevroleptika eller antipsykotika " oversatt og presentert i en spesiell form på grunnlag av de offisielle instruksjonene for medisinsk bruk av stoffet. Før bruk les annotasjonen som kom direkte til medisinen.
Beskrivelse gitt for informasjonsformål og er ikke en veiledning for selvhelbredelse. Behovet for dette legemidlet, formålet med behandlingsregimet, metoder og dose av legemidlet bestemmes utelukkende av den behandlende lege. Selvmedisin er farlig for helsen din.

