Medisinsk ekspert av artikkelen
Nye publikasjoner
Biskjoldbruskkjertlene
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
I 1879 beskrev den svenske vitenskapsmannen S. Sandström biskjoldkjertlene hos mennesker og ga dem et navn. Biskjoldkjertlene er vitale organer. Deres funksjon er å produsere og skille ut biskjoldhormon (PTH), en av de viktigste regulatorene av kalsium- og fosformetabolisme.
Den parede øvre biskjoldkjertelen (glandula parathyroidea superior) og den nedre biskjoldkjertelen (glandula parathyroidea inferior) er runde eller ovale legemer plassert på baksiden av hver av skjoldbruskkjertellappene: én kjertel øverst, den andre nederst. Lengden på hver kjertel er 4–8 mm, bredden er 3–4 mm, tykkelsen er 2–3 mm. Antallet av disse kjertlene er ikke konstant og kan variere fra 2 til 7–8, i gjennomsnitt er det fire. Den totale massen av kjertlene er i gjennomsnitt 1,18 g.
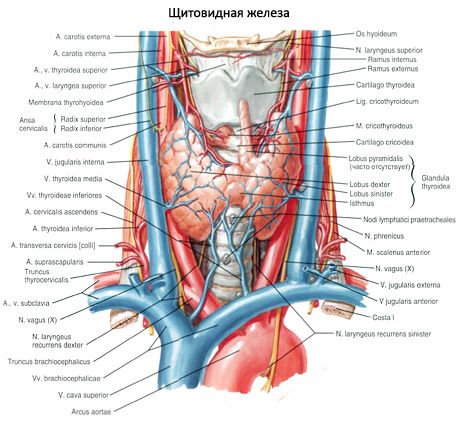
Biskjoldkjertlene skiller seg fra skjoldbruskkjertlene ved en lysere farge (hos barn er de blekrosa, hos voksne - gulbrune). Ofte er biskjoldkjertlene plassert der hvor skjoldbruskkjertelens nedre arterier eller deres grener trenger inn i skjoldbruskvevet. Biskjoldkjertlene er atskilt fra det omkringliggende vevet med sin egen fiberkapsel, hvorfra bindevevslagene strekker seg inn i kjertlene. Sistnevnte inneholder et stort antall blodårer og deler biskjoldkjertlene inn i grupper av epitelceller.
Kjertelparenkym dannes av hoved- og syrefile paratyrocytter, som danner strenger og klynger omgitt av tynne bunter av bindevevsfibre. Begge celletyper regnes som forskjellige stadier av paratyrocyttenes utvikling. Hovedparatyrocyttene har en polyedrisk form, basofil cytoplasma med et stort antall ribosomer. Blant disse cellene skilles mørke (aktivt utskillende) og lyse (mindre aktive). Syrfile paratyrocytter er store, med klare konturer, og inneholder mange små mitokondrier med glykogenpartikler.
Hormonet i biskjoldkjertlene, paratyroksin (paratyreoideahormon), har en proteinsammensetning og er involvert i reguleringen av fosfor-kalsiummetabolismen. Paratyreoideahormon reduserer kalsiumutskillelse i urin og øker absorpsjonen i tarmen i nærvær av vitamin D. Tyrocalcitonin er en antagonist av biskjoldkjertelhormon.
Embryogenese av biskjoldkjertlene
Biskjoldkjertlene utvikler seg fra epitelet i de parede III og IV gjellelommene. I den 7. utviklingsuken separeres de epiteliale rudimentene i kroppene fra veggene i gjellelommene og beveger seg i vekstprosessen i kaudal retning. Deretter inntar de dannende biskjoldkjertlene en permanent posisjon for dem på de bakre overflatene av høyre og venstre lob i skjoldbruskkjertelen.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Kar og nerver i biskjoldkjertlene
Blodtilførselen til biskjoldkjertlene skjer via grener av de øvre og nedre skjoldbruskkjertelarteriene, samt grenene av spiserøret og luftrøret. Venøst blod strømmer ut gjennom venene med samme navn. Innervasjonen av biskjoldkjertlene ligner på innervasjonen av skjoldbruskkjertelen.
Aldersrelaterte trekk ved biskjoldkjertlene
Den totale massen av biskjoldkjertlene hos en nyfødt svinger mellom 6 og 9 mg. I løpet av det første leveåret øker den totale massen 3–4 ganger, innen 5-årsalderen dobles den igjen, og innen 10-årsalderen tredobles den. Etter 20 år når den totale massen av de fire biskjoldkjertlene 120–140 mg og forblir konstant til alderdommen. I alle aldre er massen av biskjoldkjertlene hos kvinner litt større enn hos menn.
Vanligvis har en person to par biskjoldkjertler (øvre og nedre), plassert på baksiden av skjoldbruskkjertelen, utenfor kapselen, nær øvre og nedre poler. Imidlertid kan antallet og lokaliseringen av biskjoldkjertlene variere; noen ganger finnes opptil 12 biskjoldkjertler. De kan være plassert i vevet i skjoldbruskkjertelen og tymuskjertlene, i fremre og bakre mediastinum, i perikardiet, bak spiserøret, i området der halspulsåren deler seg. De øvre biskjoldkjertlene har formen av en flat eggformet form, de nedre er sfæriske. Dimensjonene deres er omtrent fra 6x3 til 4x1,5 - 3 mm, totalvekten er fra 0,05 til 0,5 g, fargen er rødlig eller gulbrun. Blodtilførselen til biskjoldkjertlene skjer hovedsakelig gjennom grenene til den nedre arteria skjoldbruskkjertelen, venøs utstrømning skjer gjennom venene i skjoldbruskkjertelen, spiserøret og luftrøret. Biskjoldkjertlene er innervert av sympatiske fibre i de tilbakevendende og øvre laryngeale nervene, mens parasympatisk innervering utføres av vagusnervene. Biskjoldkjertlene er dekket av en tynn bindevevskapsel; skilleveggene som strekker seg fra den trenger inn i kjertlene. De inneholder blodårer og nervefibre. Parenkymet i biskjoldkjertlene består av paratyrocytter, eller hovedceller, hvorav hormonelt aktive lyse eller skinnende celler, samt hvilende mørke celler, skilles ut avhengig av fargingsgraden. Hovedcellene danner klynger, snorer og klynger, og hos eldre - follikler med kolloid i hulrommet. Hos voksne oppstår celler, hovedsakelig plassert langs periferien av biskjoldkjertlene, farget med eosin - eosinofile eller oksyfile celler, som er degenererende hovedceller. I biskjoldkjertlene kan man også finne overgangsformer mellom hoved- og oksyfile celler.
De første suksessene med å avklare syntesespørsmål, dekode strukturen og studere metabolismen til paratyreoideahormon ble oppnådd etter 1972. Paratyreoideahormon er et enkeltkjedet polypeptid bestående av 84 aminosyrerester, uten cystein, med en molekylvekt på omtrent 9500 dalton, dannet i biskjoldkjertlene fra en bioprekursor - proparatyreoideahormon (proPTH), som har 6 ekstra aminosyrer ved NH2 enden. ProPTH syntetiseres i hovedcellene i biskjoldkjertlene (i deres granulære endoplasmatiske retikulum) og omdannes til biskjoldkjertelhormon i prosessen med proteolytisk spalting i Golgi-apparatet. Dens biologiske aktivitet er betydelig lavere enn aktiviteten til PTH. Tilsynelatende er proPTH fraværende i blodet til friske mennesker, men under patologiske tilstander (med adenom i biskjoldkjertlene) kan det skilles ut i blodet sammen med PTH. Nylig ble en forløper til proPTH, preproPTH, oppdaget som inneholder ytterligere 25 aminosyrerester ved NH2-terminalen. Dermed inneholder preproPTH 115 aminosyrerester, proPTH - 90 og PTH - 84.
Strukturen til biskytthormon fra svin og storfe er nå fullstendig fastslått. Humant biskytthormon er blitt isolert fra biskyttkjerteladenomer, men strukturen er bare delvis forstått. Det er forskjeller i strukturen til biskytthormon, men biskytthormoner fra dyr og mennesker viser kryssimmunreaktivitet. Polypeptidet som består av de første 34 aminosyrerestene beholder praktisk talt den biologiske aktiviteten til det naturlige hormonet. Dette lar oss anta at de resterende nesten % av molekylet i karboksylenden ikke er direkte relatert til hovedeffektene av biskytthormon. Fragment 1-29 av biskytthormon viser også en viss biologisk og immunologisk aktivitet. Biologisk inaktivt fragment 53-84 viser også en immunologisk effekt, dvs. at disse egenskapene til biskytthormon vises i minst to seksjoner av molekylet.
Paratyreoideahormonet som sirkulerer i blodet er heterogent og skiller seg fra det naturlige hormonet som skilles ut av biskjoldkjertlene. Minst tre forskjellige typer paratyreoideahormon skilles ut i blodet: intakt paratyreoideahormon med en molekylvekt på 9500 dalton; biologisk inaktive stoffer fra karboksyldelen av paratyreoideahormonmolekylet med en molekylvekt på 7000–7500 dalton; biologisk aktive stoffer med en molekylvekt på omtrent 4000 dalton.
Enda mindre fragmenter ble funnet i venøst blod, noe som indikerer at de ble dannet i periferien. De viktigste organene der fragmenter av paratyreoideahormon ble dannet var lever og nyrer. Fragmentering av paratyreoideahormon i disse organene var økt ved leverpatologi og kronisk nyresvikt (CRF). Under disse forholdene forble fragmenter av paratyreoideahormon i blodet betydelig lenger enn hos friske individer. Leveren absorberte hovedsakelig intakt paratyreoideahormon, men fjernet verken karboksylterminale eller aminoterminale paratyreoideahormonfragmenter fra blodet. Nyrene spilte en ledende rolle i metabolismen av paratyreoideahormon. De sto for nesten 60 % av metabolsk clearance av karboksylterminalt immunreaktivt hormon og 45 % av det aminoterminale fragmentet av paratyreoideahormon. Hovedområdet for metabolisme av det aktive aminoterminale fragmentet av paratyreoideahormon var bein.
Pulserende sekresjon av parathyroidhormon ble observert, mest intens om natten. Etter 3–4 timer fra nattens søvn er innholdet i blodet 2,5–3 ganger høyere enn gjennomsnittlig nivå på dagtid.
Hovedfunksjonen til paratyreoideahormonet er å opprettholde kalsiumhomeostase. Samtidig er serumkalsium (totalt og spesielt ionisert) hovedregulatoren for paratyreoideahormonsekresjon (en reduksjon i kalsiumnivåer stimulerer paratyreoideahormonsekresjon, mens en økning undertrykker den), dvs. reguleringen utføres i henhold til tilbakekoblingsprinsippet. Under hypokalsemi øker omdannelsen av proPTH til paratyreoideahormon. Magnesiuminnholdet i blodet spiller også en viktig rolle i frigjøringen av paratyreoideahormon (det økte nivået stimulerer, mens det reduserte nivået undertrykker paratyreoideahormonsekresjon). Hovedmålene for paratyreoideahormonet er nyrer og skjelett, men effekten av paratyreoideahormon på kalsiumabsorpsjon i tarmen, karbohydrattoleranse, serumlipidnivåer, dets rolle i utviklingen av impotens, hudkløe, etc. er kjent.
For å karakterisere effekten av parathyroidhormon på bein, er det nødvendig å gi kort informasjon om strukturen til beinvev, egenskapene til dets fysiologiske resorpsjon og ombygging.
Det er kjent at mesteparten av kalsium i kroppen (opptil 99 %) finnes i beinvev. Siden det finnes i bein i form av fosfor-kalsiumforbindelser, finnes % av det totale fosforinnholdet også i bein. Vevet deres, til tross for sin tilsynelatende statiske natur, ombygges kontinuerlig, aktivt vaskulariseres og har høye mekaniske egenskaper. Bein er et dynamisk "depot" av fosfor, magnesium og andre forbindelser som er nødvendige for å opprettholde homeostase i mineralmetabolismen. Strukturen inkluderer tette mineralkomponenter som er nært beslektet med den organiske matrisen, som består av 90-95 % kollagen, små mengder mukopolysakkarider og ikke-kollagenproteiner. Mineraldelen av beinet består av hydroksyapatitt - dens empiriske formel er Ca10 (PO4) 6 (OH) 2 - og amorft kalsiumfosfat.
Bein dannes av osteoblaster som stammer fra udifferensierte mesenkymceller. Dette er mononukleære celler som er involvert i syntesen av komponenter i den organiske beinmatrisen. De er plassert i et monolag på beinoverflaten og er i nær kontakt med osteoid. Osteoblaster er ansvarlige for avsetning av osteoid og den påfølgende mineraliseringen. Produktet av deres vitale aktivitet er alkalisk fosfatase, hvis innhold i blodet er en indirekte indikator på deres aktivitet. Omgitt av mineralisert osteoid, omdannes noen osteoblaster til osteocytter - mononukleære celler, hvis cytoplasma danner kanaler assosiert med kanalene til nærliggende osteocytter. De deltar ikke i beinombygging, men er involvert i prosessen med perilacunar destruksjon, noe som er viktig for rask regulering av kalsiumnivåer i blodserumet. Beinresorpsjon utføres av osteoklaster - gigantiske polynukleære celler, tilsynelatende dannet ved fusjon av mononukleære makrofager. Det antas også at forløperne til osteoklaster kan være hematopoietiske stamceller i benmargen. De er mobile og danner et lag i kontakt med beinet, plassert i områder med størst resorpsjon. På grunn av frigjøring av proteolytiske enzymer og syrefosfatase forårsaker osteoklaster kollagennedbrytning, hydroksyapatittødeleggelse og fjerning av mineraler fra matriksen. Nydannet dårlig mineralisert beinvev (osteoid) er resistent mot osteoklastisk resorpsjon. Funksjonene til osteoblaster og osteoklaster er uavhengige, men koordinert med hverandre, noe som fører til normal skjelettremodellering. Beinvekst i lengde avhenger av endokondral ossifikasjon, vekst i bredde og tykkelse - av periosteal ossifikasjon. Kliniske studier med 47 Ca har vist at opptil 18 % av det totale kalsiuminnholdet i skjelettet fornyes hvert år. Når bein skades (brudd, infeksjonsprosesser), resorberes det endrede beinet og nytt bein dannes.
Cellekomplekser involvert i den lokale prosessen med benresorpsjon og -dannelse kalles basale flercellede ombyggingsenheter (BMU-er). De regulerer den lokale konsentrasjonen av kalsium, fosfor og andre ioner, syntesen av organiske komponenter i bein, spesielt kollagen, dets organisering og mineralisering.
Hovedeffekten av paratyreoideahormon i skjelettets bein er å forbedre resorpsjonsprosessene, noe som påvirker både mineralske og organiske komponenter i beinstrukturen. Paratyreoideahormon fremmer veksten av osteoklaster og deres aktivitet, som er ledsaget av en forbedret osteolytisk effekt og en økning i beinresorpsjon. I dette tilfellet oppløses hydroksyapatittkrystaller med frigjøring av kalsium og fosfor i blodet. Denne prosessen er hovedmekanismen for å øke nivået av kalsium i blodet. Den består av tre komponenter: mobilisering av kalsium fra perilakunærbenet (dype osteocytter); proliferasjon av osteoprogeneratorceller til osteoklaster; opprettholdelse av et konstant nivå av kalsium i blodet ved å regulere frigjøringen fra beinet (overfladiske osteocytter).
Dermed øker paratyreoideahormon i utgangspunktet aktiviteten til osteocytter og osteoklaster, noe som forsterker osteolysen, noe som forårsaker en økning i kalsiumnivået i blodet og økt utskillelse av kalsium og oksyprolin i urinen. Dette er den første, kvalitative, raske effekten av paratyreoideahormon. Den andre effekten av paratyreoideahormon på bein er kvantitativ. Den er assosiert med en økning i mengden osteoklaster. Ved aktiv osteolyse oppstår en stimulans for økt proliferasjon av osteoblaster, både resorpsjon og beindannelse med en overvekt av resorpsjon aktiveres. Ved et overskudd av paratyreoideahormon oppstår en negativ beinbalanse. Dette er ledsaget av overdreven utskillelse av oksyprolin - et produkt av kollagennedbrytning og sialinsyrer som er inkludert i strukturen til mukopolysakkarider. Paratyreoideahormon aktiverer syklisk adenosinmonofosfat (cAMP). Økt utskillelse av cAMP i urinen etter administrering av paratyreoideahormon kan tjene som en indikator på vevsfølsomhet for det.
Den viktigste effekten av paratyreoideahormon på nyrene er dets evne til å redusere fosforreabsorpsjon, noe som øker fosfati. Mekanismen for reduksjon i forskjellige deler av nefronet er forskjellig: i den proksimale delen skyldes denne effekten av paratyreoideahormon økt permeabilitet og skjer med deltakelse av cAMP, mens den i den distale delen ikke er avhengig av cAMP. Den fosfatiske effekten av paratyreoideahormon endres med vitamin D-mangel, metabolsk acidose og redusert fosforinnhold. Paratyreoideahormoner øker den totale tubulære reabsorpsjonen av kalsium noe. Samtidig reduserer det den i de proksimale delene og øker den i de distale delene. Sistnevnte er av dominerende betydning - paratyreoideahormon reduserer kalsiumclearance. Paratyreoideahormon reduserer den tubulære reabsorpsjonen av natrium og dets bikarbonat, noe som kan forklare utviklingen av acidose ved hyperparatyreoidisme. Det øker dannelsen av 1,25-dioksykolekalsiferol 1,25(OH 2 )D 3 i nyrene - den aktive formen av vitamin D 3. Denne forbindelsen øker kalsiumreabsorpsjonen i tynntarmen ved å stimulere aktiviteten til et spesifikt kalsiumbindende protein (CaBP) i veggen.
Normalnivået av paratyreoideahormon er i gjennomsnitt 0,15–0,6 ng/ml. Det varierer avhengig av alder og kjønn. Gjennomsnittlig innhold av paratyreoideahormon i blodet hos personer i alderen 20–29 år er (0,245 ± 0,017) ng/ml, 80–89 år – (0,545 ± 0,048) ng/ml. Nivået av paratyreoideahormon hos 70 år gamle kvinner er (0,728 ± 0,051) ng/ml, og hos menn i samme alder – (0,466 ± 0,40) ng/ml. Dermed øker innholdet av paratyreoideahormon med alderen, men i større grad hos kvinner.
Som regel bør flere forskjellige tester brukes for differensialdiagnose av hyperkalsemi.
Vi presenterer den kliniske og patogenetiske klassifiseringen utviklet av oss, basert på klassifiseringen til OV Nikolaev og VN Tarkaeva (1974).
Klinisk og patogenetisk klassifisering av sykdommer assosiert med nedsatt sekresjon av parathyroidhormon og følsomhet for det
Primær hyperparatyreoidisme
- Ved patogenese:
- hyperfungerende adenom(er);
- hyperplasi av OGD;
- hyperfungerende biskjoldbruskkjertelkarsinom;
- multippel endokrin neoplasi type I med hyperparatyreoidisme (Wermers syndrom);
- multippel endokrin neoplasi type II med hyperparatyreoidisme (Sipple syndrom).
- I henhold til kliniske trekk:
- beinform:
- osteoporotisk,
- fibrocystisk osteitt,
- "Pagetoid";
- visceropatisk form:
- med overveiende skade på nyrene, mage-tarmkanalen, nevropsykiatrisk sfære;
- blandet form.
- beinform:
- Nedstrøms:
- krydret;
- kronisk.
Sekundær hyperparatyreoidisme (sekundær hyperfunksjon og hyperplasi av biskjoldkjertlene med langvarig hypokalsemi og hyperfosfatemi)
- Nyrepatologi:
- kronisk nyresvikt;
- tubulopati (Albright-Fanconi-type);
- nyre rakitt.
- Tarmpatologi:
- malabsorpsjonssyndrom.
- Benpatologi:
- senil osteomalasi;
- barselstid;
- idiopatisk;
- Pagets sykdom.
- Vitamin D-mangel:
- nyresykdom;
- lever;
- arvelige enzymmangler.
- Ondartede sykdommer: myelomatose.
Tertiær hyperparatyreoidisme
- Autonomt fungerende adenom(er) i biskjoldkjertlene, som utvikler seg mot bakgrunn av langvarig sekundær hyperparatyreoidisme.
Pseudohyperparatyreoidisme
- Produksjon av parathyroidhormon av svulster av ikke-parathyroidhormonopprinnelse.
Hormonelt inaktive cystiske og tumorformasjoner i biskjoldkjertlene
- Cyste.
- Hormonelt inaktive svulster eller karsinom.
Hypoparatyreoidisme
- Medfødt underutvikling eller fravær av biskjoldkjertlene.
- Idiopatisk, autoimmun opprinnelse.
- Postoperativt, utviklet i forbindelse med fjerning av biskjoldkjertlene.
- Postoperativt på grunn av nedsatt blodtilførsel og innervasjon.
- Strålingsskader, eksogene og endogene (ekstern strålebehandling, behandling av skjoldbruskkjertelsykdom med radioaktivt jod).
- Skade på biskjoldkjertlene på grunn av blødning eller infarkt.
- Smittsomme lesjoner.
Pseudohypoparatyreoidisme
- Type I - ufølsomhet i målorganene for parathyroidhormon, avhengig av adenylatcyklase;
- Type II - målorganenes ufølsomhet for paratyreoideahormon, uavhengig av adenylatcyklase, muligens av autoimmun opprinnelse.
Pseudopseudohypoparatyreoidisme
Tilstedeværelsen av somatiske tegn på pseudohypoparatyreoidisme hos friske slektninger i familier med pasienter med pseudohypoparatyreoidisme uten karakteristiske biokjemiske lidelser og uten tetani.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

