Medisinsk ekspert av artikkelen
Nye publikasjoner
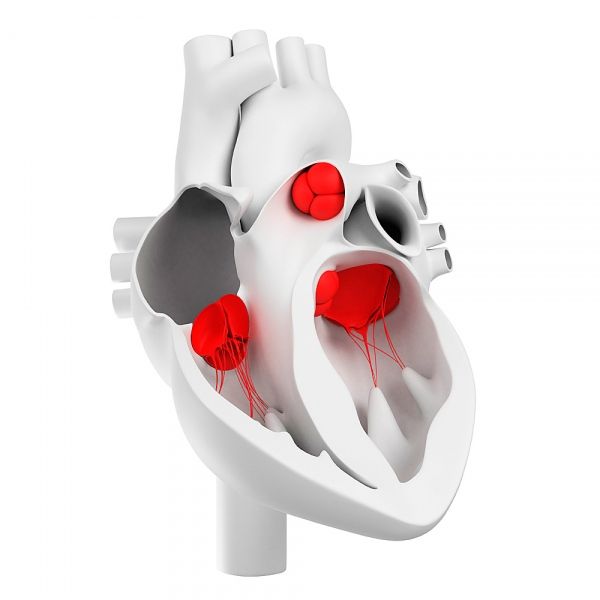
Hjerteklaffer
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Tidligere trodde man at alle hjerteklaffer var enkle strukturer hvis bidrag til ensrettet blodstrøm ganske enkelt var passiv bevegelse som respons på en påført trykkgradient. Denne forståelsen av "passive strukturer" førte til utviklingen av "passive" mekaniske og biologiske klafferstatninger.
Det blir nå tydelig at hjerteklaffer har en mer kompleks struktur og funksjon. Derfor forutsetter etableringen av en "aktiv" hjerteklafferstatning en betydelig likhet i struktur og funksjon med den naturlige hjerteklaffen, noe som i fremtiden er ganske realistisk takket være utviklingen av vevsteknologi.
Hjerteklaffer utvikles fra embryonale rudimenter av mesenkymalt vev under dannelsen av endokardiet. Under morfogenesen dannes atrioventrikulærkanalen (trikuspidal- og mitralklaffene) og ventrikulær utstrømningskanal (aorta- og pulmonalklaffer).
Hvordan er hjerteklaffene ordnet?
Studien av blodtilførselen til klaffene ble initiert av N. Luschka (1852), som injiserte hjertekarene med en kontrastmasse. Han oppdaget en rekke blodkar i klaffene til atrioventrikulære og semilunarklaffene i aorta og lungearterien. Samtidig inneholdt en rekke manualer om patologisk anatomi og histologi indikasjoner på at uendrede menneskelige hjerteklaffer ikke inneholder blodkar, og sistnevnte forekommer i klaffene bare i ulike patologiske prosesser - aterosklerose og endokarditt av ulike etiologier. Informasjon om fraværet av blodkar var hovedsakelig basert på histologiske studier. Det ble antatt at i fravær av blodkar i den frie delen av klaffene, skjer ernæringen deres ved å filtrere væske fra blodplasmaet som vasker klaffene. Penetrasjon av noen få kar sammen med fibre av tverrstripet muskelvev inn i basene til klaffene og senebåndene ble observert.
Når man imidlertid injiserte hjertekar med forskjellige fargestoffer (indisk blekk i gelatin, vismut i gelatin, vandig suspensjon av svart indisk blekk, løsninger av karmin eller trypanblått), ble det funnet at karene penetrerer atrioventrikulære hjerteklaffer, aortaklaffene og lungearterien sammen med hjertemuskelvevet, litt før de når den frie kanten av klaffen.
I det løse fibrøse bindevevet i atrioventrikulære klaffkusper ble det funnet individuelle hovedkar som anastomoserte med kar i tilstøtende områder av tverrstripet hjertemuskelvev.
Det største antallet blodkar var plassert ved basen og et forholdsvis mindre antall i den frie delen av disse klaffene.
Ifølge KI Kulchitsky et al. (1990) finnes det en større diameter på arterielle og venøse kar i mitralklaffen. Ved bunnen av klaffens kupler er det hovedsakelig hovedkar med et smalt sløyfenettverk av kapillærer, som trenger inn i den basale delen av kuplen og opptar 10 % av arealet. I trikuspidalklaffen har arteriekarene en mindre diameter enn i mitralklaffen. I kuplene til denne klaffen er det hovedsakelig spredte kar og forholdsvis brede løkker av blodkapillærer. I mitralklaffen forsynes den fremre kuplen mer intensivt med blod, i trikuspidalklaffen - de fremre og bakre kuplene, som utfører den viktigste lukkefunksjonen. Forholdet mellom diameteren på de arterielle og venøse karene i atrioventrikulærklaffene i hjertet hos voksne mennesker er 1:1,5. Kapillærløkkene er polygonale og er plassert vinkelrett på bunnen av klaffens kupler. Karene danner et plant nettverk plassert under endotelet på atriesiden. Blodkar finnes også i senebåndene, hvor de trenger inn fra papillarmusklene i høyre og venstre ventrikkel i en avstand på opptil 30 % av lengden på senebåndene. Tallrike blodkar danner bueformede løkker ved bunnen av senebåndene. Hjerteklaffene i aorta og pulmonalstammen skiller seg betydelig fra atrioventrikulærklaffene når det gjelder blodtilførsel. Hovedkarene med relativt mindre diameter nærmer seg bunnen av halvmåneformede cusper i aorta- og pulmonalstammeklaffene. De korte grenene til disse karene ender i kapillærløkker med uregelmessig oval og polygonal form. De er hovedsakelig plassert nær bunnen av halvmåneformede cusper. De venøse karene ved bunnen av aorta- og pulmonalklaffene har også en mindre diameter enn de ved bunnen av atrioventrikulærklaffene. Forholdet mellom diameteren til de arterielle og venøse karene i aorta- og pulmonalklaffene i hjertet hos voksne mennesker er 1:1,4. Korte sidegrener strekker seg fra de større karene og ender i kapillærløkker med uregelmessig oval og polygonal form.

Med alderen skjer en forgroving av bindevevsfibre, både kollagen og elastisk, samt en reduksjon i mengden løst fibrøst uformet bindevev, sklerose av vevet i atrioventrikulærklaffene og halvmåneformede klaffer i aorta- og pulmonalarterieklaffene utvikler seg. Lengden på de tverrstripete hjertemuskelfibrene i klaffene reduseres, og følgelig reduseres mengden og antallet blodkar som trenger inn i hjerteklaffene. På grunn av disse endringene mister hjerteklaffene sine elastiske og ettergivende egenskaper, noe som påvirker mekanismen for klafflukking og hemodynamikk.
Hjerteklaffene har nettverk av lymfekapillærer og et lite antall lymfekar utstyrt med klaffer. De lymfekapillærene i klaffene har et karakteristisk utseende: lumen er svært ujevn, den samme kapillæren har ulik diameter på forskjellige steder. På steder der flere kapillærer smelter sammen, dannes det utvidelser - hull i forskjellige former. Sløyfene i nettverkene er ofte uregelmessige polygonale, sjeldnere ovale eller runde. Ofte er løkkene i lymfenettverkene ikke lukket, og lymfekapillærene ender blindt. Sløyfene i lymfekapillærene er oftest orientert i retning fra den frie kanten av klaffen til dens base. I noen tilfeller ble det funnet et tolags nettverk av lymfekapillærer i klaffene til atrioventrikulærklaffen.
De endokardielle nervepleksene er plassert i sine forskjellige lag, hovedsakelig under endotelet. Ved den frie kanten av klaffenes cusper er nervefibrene hovedsakelig plassert radielt, og koblet til de seneformede chordae. Nærmere bunnen av cuspene dannes en stormasket nervepleksus, som er koblet til plexusen som ligger rundt de fibrøse ringene. På de halvmåneformede cuspene er det endokardielle nervenettverket mer sparsomt. På klaffenes festested blir det tett og flerlags.
Cellestrukturen til hjerteklaffene
Klaffinterstitielle celler, som er ansvarlige for å opprettholde klaffens struktur, har en avlang form med en rekke fine utløpere som strekker seg gjennom klaffmatrisen. Det finnes to populasjoner av klaffinterstitielle celler som varierer i morfologi og struktur; den ene har kontraktile egenskaper og er karakterisert ved tilstedeværelsen av kontraktile fibriller, den andre har sekretoriske egenskaper og har et velutviklet endoplasmatisk retikulum og Golgi-apparat. Kontraktil funksjon motstår hemodynamisk trykk og støttes videre av produksjonen av både hjerte- og skjelettkontraktile proteiner, som inkluderer de tunge kjedene til alfa- og beta-myosin og forskjellige isoformer av troponin. Sammentrekning av hjerteklaffens blad er demonstrert som respons på en rekke vasoaktive stoffer, noe som tyder på en koordinert biologisk stimulus for vellykket klafffunksjon.
Interstitielle celler er også essensielle komponenter i reparasjonssystemet til strukturer som hjerteklaffer. Den konstante bevegelsen av klaffbladene og den tilhørende bindevevsdeformasjonen produserer skade som klaffinterstitielle celler reagerer på for å opprettholde klaffens integritet. Reparasjonsprosessen ser ut til å være avgjørende for normal klafffunksjon, og fraværet av disse cellene i nåværende kunstige klaffmodeller er sannsynligvis en medvirkende faktor til strukturell skade på bioproteser.
Et viktig forskningsområde innen interstitielle celler er studiet av interaksjoner mellom dem og den omkringliggende matrisen mediert av fokale adhesjonsmolekyler. Fokale adhesjoner er spesialiserte celle-matrise-interaksjonssteder som kobler cellecytoskjelettet til matriksproteiner via integriner. De fungerer også som signaltransduksjonssteder, og videresender mekanisk informasjon fra den ekstracellulære matrisen som kan fremkalle responser, inkludert, men ikke begrenset til, celleadhesjon, migrasjon, vekst og differensiering. Å forstå cellebiologien til klaffinterstitielle celler er avgjørende for å belyse mekanismene som disse cellene samhandler med hverandre og miljøet sitt gjennom, slik at denne funksjonen kan gjenskapes i kunstige klaffer.
I forbindelse med utviklingen av en lovende retning innen vevsteknologi av hjerteklaffer, utføres studier av interstitielle celler ved hjelp av et bredt spekter av teknikker. Tilstedeværelsen av cellecytoskjelettet bekreftes ved farging for vimentin, desmin, troponin, alfa-aktin og glattmuskelmyosin, tunge kjeder av alfa- og beta-myosin, lette kjeder-2 av hjertemyosin, alfa- og beta-tubulin. Cellekontraktilitet bekreftes ved en positiv respons på adrenalin, angiotensin II, bradykinin, karbakol, kaliumklorid, endotel I. Cellulære sammenhenger bestemmes ved funksjonelle gap-interaksjoner og verifiseres ved mikroinjeksjoner av karboksyfluorescein. Matriksekresjon etableres ved farging for prolyl-4-hydroksylase/kollagen type II, fibronektin, kondroitinsulfat, laminin. Innervasjon etableres ved den nære plasseringen av motoriske nerveender, noe som gjenspeiles av aktiviteten til nevropeptid Y tyrosinhydroksylase, acetylkolinesterase, vasoaktivt intestinalt polypeptid, substans-P, capsicum-genrelatert peptid. Mitogene faktorer estimeres ved hjelp av blodplateavledet vekstfaktor, basisk fibroblastvekstfaktor, serotonin (5-HT). De studerte interstitielle cellefibroblastene er karakterisert av en ufullstendig basalmembran, lange, tynne cytoplasmatiske prosesser, nær forbindelse med matriksen, velutviklet ujevnt endoplasmatisk retikulum og Golgi-apparat, rikdom i mikrofilamenter og dannelse av adhesive bindinger.
Klaffceller i endokardiet danner en funksjonell atrombogen kappe rundt hver hjerteklaff, på samme måte som det vaskulære endotelet. Den mye brukte metoden for klaffutskifting eliminerer endokardiets beskyttende funksjon, noe som kan føre til avsetning av blodplater og fibrin på kunstige klaffer, utvikling av bakteriell infeksjon og forkalkning av vevet. En annen sannsynlig funksjon for disse cellene er reguleringen av de underliggende interstitielle klaffene, på samme måte som endotelet regulerer glatte muskelceller. Komplekse interaksjoner eksisterer mellom endotelet og tilstøtende celler, delvis mediert av løselige faktorer som skilles ut av endotelcellene. Disse cellene danner en enorm overflate dekket med mikroutstikkere på den luminale siden, og øker dermed eksponeringen for og mulig interaksjon med metabolske stoffer i det sirkulerende blodet.
Endotelet viser ofte morfologiske og funksjonelle forskjeller forårsaket av skjærspenninger på karveggen på grunn av blodstrøm, og dette gjelder også de klaffendokardiale cellene, som enten antar en langstrakt eller polygonal form. Endringer i cellestrukturen kan oppstå på grunn av virkningen av lokal hemodynamikk på komponenter i cellecytoskjelettet eller sekundære effekter forårsaket av endringer i den underliggende ekstracellulære matrisen. På ultrastrukturnivå har klaffendokardiale celler intercellulære forbindelser, plasmavesikler, et grovt endoplasmatisk retikulum og et Golgi-apparat. Selv om de produserer von Willebrand-faktor både in vivo og in vitro, mangler de Weibel-Palade-legemer (spesifikke granuler som inneholder von Willebrand-faktor), som er organeller som er karakteristiske for det vaskulære endotelet. Klaffendokardiale celler er preget av sterke forbindelser, funksjonelle gapinteraksjoner og overlappende marginale folder.
Endokardceller beholder sin metabolske aktivitet selv in vitro: de produserer von Willebrand-faktor, prostacyklin, nitrogenoksidsyntase, viser angiotensin-konverterende enzymaktivitet og utskiller intensivt adhesjonsmolekyler ICAM-1 og ELAM-1, som er viktige for binding av mononukleære celler under utviklingen av en immunrespons. Alle disse markørene bør tas i betraktning når man dyrker en ideell cellekultur for å lage en kunstig klaff ved hjelp av vevsteknikk, men det immunstimulerende potensialet til selve klaffendokardceller kan begrense bruken av dem.
Den ekstracellulære matrisen i hjerteklaffene består av fibrøst kollagen og elastin-makromolekyler, proteoglykaner og glykoproteiner. Kollagen utgjør 60 % av klaffens tørrvekt, elastin for 10 % og proteoglykaner for 20 %. Kollagenkomponenten gir den viktigste mekaniske stabiliteten til klaffen og er representert av kollagener av type I (74 %), II (24 %) og V (2 %). Bunter av kollagentråder er omgitt av en elastinkappe, som formidler interaksjoner mellom dem. Glykosaminoglykan-sidekjedene i proteoglykanmolekyler har en tendens til å danne et gellignende stoff der andre matriksmolekyler samhandler for å danne permanente bindinger og andre komponenter avsettes. Glykosaminoglykaner i menneskelige hjerteklaffer består hovedsakelig av hyaluronsyre, i mindre grad av dermatansulfat, kondroitin-4-sulfat og kondroitin-6-sulfat, med en minimal mengde heparansulfat. Ombygging og fornyelse av matriksvev reguleres av matriksmetalloproteinaser (MMP-er) og deres vevshemmere (TI-er). Disse molekylene er også involvert i et bredere spekter av fysiologiske og patologiske prosesser. Noen metalloproteinaser, inkludert interstitielle kollagenaser (MMP-1, MMP-13) og gelatinaser (MMP-2, MMP-9) og deres vevshemmere (TI-1, TI-2, TI-3), finnes i alle hjerteklaffer. Overdreven produksjon av metalloproteinaser er karakteristisk for patologiske tilstander i hjerteklaffen.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Hjerteklaffer og deres morfologiske struktur
Hjerteklaffer består av tre morfologisk forskjellige og funksjonelt signifikante lag i bladmatrisen: fibrøse, svampaktige og ventrikulære.
Det fiberholdige laget danner et lastbestandig rammeverk for klaffens blad, bestående av lag med kollagenfibre. Disse fibrene er anordnet radielt i folder for å la arterieklaffene strekke seg når de lukkes. Det fiberholdige laget ligger nær den ytre utløpsflaten til disse klaffene. Det fiberholdige laget i atrioventrikulærklaffene fungerer som en fortsettelse av kollagenbuntene i chordae tendineae. Det ligger mellom det svampaktige (innløps-) og ventrikulære (utløps-) laget.
Mellom fibrøse og ventrikulære lag ligger det svampaktige laget (spongiosa). Det svampaktige laget består av dårlig organisert bindevev i et viskøst medium. De dominerende matrikskomponentene i dette laget er proteoglykaner med tilfeldig orientert kollagen og tynne lag med elastin. Sidekjedene til proteoglykanmolekylene har en sterk negativ ladning, noe som påvirker deres høye evne til å binde vann og danne en porøs matriksgel. Det svampaktige laget i matriksen reduserer mekanisk stress i hjerteklaffenes blader og opprettholder deres fleksibilitet.
Ventrikkellaget er mye tynnere enn de andre og er rikt på elastiske fibre som gjør at vevet kan motstå konstant deformasjon. Elastin har en svampaktig struktur som omgir og forbinder kollagenfibre og holder dem i en nøytral foldet tilstand. Innløpslaget til klaffen (ventrikulært - for arterielle klaffer og svampaktig - for atrioventrikulært) inneholder mer elastin enn utløpet, noe som sørger for mykgjøring av det hydrauliske støtet når cuspene lukkes. Dette forholdet mellom kollagen og elastin gjør at cuspene kan strekke seg opptil 40 % uten stabil deformasjon. Når de utsettes for en liten belastning, er kollagenstrukturene i dette laget orientert i retning av belastningen, og motstanden mot ytterligere belastningsvekst øker.
Dermed er ideen om hjerteklaffene som enkle endokardielle duplikasjoner ikke bare forenklet, men også i hovedsak feil. Hjerteklaffer er komplekse organer som inkluderer tverrstripete muskelfibre, blod- og lymfekar og nerveelementer. Klaffene er integrerte i alle hjertestrukturer, både i struktur og funksjon. Analyse av normal klafffunksjon må ta hensyn til dens cellulære organisering, samt samspillet mellom celler med hverandre og matrisen. Kunnskapen fra slike studier er ledende innen design og utvikling av klaffproteser ved bruk av vevsteknikk.

