Medisinsk ekspert av artikkelen
Nye publikasjoner
Humant immunsviktvirus (HIV)
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Ervervet immunsviktsyndrom ble identifisert som en spesifikk sykdom i 1981 i USA, da en rekke unge mennesker utviklet alvorlige sykdommer forårsaket av mikroorganismer som var ikke-patogene eller svakt patogene for friske mennesker. En studie av pasientenes immunstatus viste en kraftig nedgang i antall lymfocytter generelt og T-hjelpere spesielt. Denne tilstanden ble kalt AIDS (ervervet immunsviktsyndrom). Smittemetoden (seksuell kontakt, gjennom blod og dets preparater) indikerte sykdommens smittsomme natur.
Årsaksagensen til AIDS ble oppdaget i 1983 uavhengig av franskmannen L. Montagnier, som kalte det LAV Lymfoadenopati-assosiert virus, siden han fant det hos en pasient med lymfadenopati; og amerikaneren R. Gallo, som kalte viruset HTLV-III (Human T-lymphotropic Virus III): han hadde tidligere oppdaget lymfotrope virus I og II.
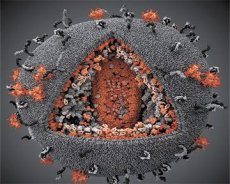
En sammenligning av egenskapene til LAV- og HTLV-III-virusene viste deres identitet, så for å unngå forvirring ble viruset kalt HIV (Human Immunodeficiency Virus, eller HIV) i 1986. HIV er sfærisk i form, med en diameter på 110 nm. Virushylsteret har formen av et polyeder, bestående av 12 femkanter og 20 sekskanter. I midten og hjørnene av hver sekskant er et molekyl av glykosylert protein gpl20 (tallet 120 indikerer proteinets molekylvekt i kilodalton). Totalt 72 gpl20-molekyler er plassert på overflaten av virionet i form av spesielle pigger, som hver er assosiert med det intramembrane proteinet gp41. Disse proteinene, sammen med det doble lipidlaget, danner superkapsidet (membranen) til virionet.
Proteinene gpl20 og gp41 dannes ved å kutte Env-forløperproteinet av en cellulær protease. Gp41-proteinet danner spike-"stammen" ved å binde seg med sitt cytoplasmatiske domene til matriksproteinet p17MA som ligger rett under konvolutten. p17-molekylene samhandler under virionmodningen for å danne et ikosaeder under konvolutten.
I den sentrale delen av virionet danner p24-proteinet en kjegleformet kapsid. Den innsnevrede delen av kapsidet er koblet til virionmembranen med deltakelse av rb-proteinet. Inne i kapsidet er det to identiske molekyler av viralt genomisk RNA. De er koblet sammen med sine 5'-ender til nukleokapsidproteinet p7NC. Dette proteinet er interessant fordi det har to aminosyrerester (motiver) rike på cystein og histidin og som inneholder et Zn-atom - de kalles "sinkfingre" fordi de fanger opp molekyler av genomisk RNA for inkludering i de dannende virionene. Kapsidet inneholder også tre enzymer. Revertase (RT), eller pol-komplekset, inkluderer revers transkriptase, RNase H og DNA-avhengig DNA-polymerase. Revertase er tilstede som en heterodimer p66/p51. Protease (PR) - p10, initierer og implementerer prosessen med virionmodning. Integrase (IN) - p31, eller endonuklease, sikrer inkludering av proviralt DNA i vertscellens genom. Kapsidet inneholder også et molekyl av primer-RNA (tRNAl"3).
RNA-genomet i cellen omdannes til et DNA-genom (DNA-provirus) ved hjelp av revers transkriptase, bestående av 9283 nukleotidpar. Det er avgrenset på venstre og høyre side av såkalte lange terminale repeats, eller LTR-er: S'-LTR på venstre side og 3'-LTR på høyre side. LTR-er inneholder 638 nukleotidpar hver.
HIV-genomet består av 9 gener, hvorav noen overlapper hverandre i endene (har flere leserammer) og har en eksonintronstruktur. De kontrollerer syntesen av 9 strukturelle og 6 regulatoriske proteiner.
Betydningen av LTR-er for virusgenomet er at de inneholder følgende regulatoriske elementer som kontrollerer dets funksjon:
- transkripsjonssignal (promotorregion);
- poly-A-addisjonssignal;
- signal for avslutning av tak;
- integrasjonssignal;
- positivt reguleringssignal (TAR for TAT-protein);
- negativt regulatorisk element (NRE for NEF-protein);
- et festested for primer-RNA (tRNA™3) for minus-tråd-DNA-syntese i 3'-enden; et signal i 5'-enden av LTR som fungerer som en primer for pluss-tråd-DNA-syntese.
I tillegg inneholder LTR elementer involvert i reguleringen av mRNA-spleising, pakking av vRNA-molekyler inn i kapsidet (Psi-element). Til slutt, under genomtranskripsjonen, dannes to signaler i lange mRNAer for REV-proteinet, som bytter proteinsyntese: CAR - for regulatoriske proteiner og CRS - for strukturelle proteiner. Hvis REV-proteinet binder seg til CAR, syntetiseres strukturelle proteiner; hvis det er fraværende, syntetiseres bare regulatoriske proteiner.
Følgende regulatoriske gener og deres proteiner spiller en spesielt viktig rolle i reguleringen av virusgenomets funksjon:
- TAT-protein, som utfører positiv kontroll av virusreplikasjon og virker gjennom TAR-regulatorregionen;
- NEV- og VPU-proteiner, som utøver negativ kontroll over replikasjon gjennom NRE-regionen;
- REV-protein, som utfører positiv-negativ kontroll. REV-proteinet kontrollerer arbeidet til gag-, pol- og env-genene og utfører negativ regulering av spleising.
Dermed er HIV-replikasjonen under trippel kontroll - positiv, negativ og positiv-negativ.
VIF-proteinet bestemmer infeksjonsevnen til det nysyntetiserte viruset. Det er assosiert med p24-kapsidproteinet og er tilstede i virionet i en mengde på 60 molekyler. NEF-proteinet er representert i virionet av et lite antall molekyler (5–10), muligens assosiert med membranen.
VPR-proteinet hemmer cellesyklusen i G2-fasen, deltar i transporten av preintegrasjonskomplekser inn i cellekjernen, aktiverer noen virale og cellulære gener og øker effektiviteten av virusreplikasjon i monocytter og makrofager. Plasseringen av VPR-, TAT-, REV- og VPU-proteinene i virionet er ikke fastslått.
I tillegg til sine egne proteiner kan virionmembranen inneholde noen proteiner fra vertscellen. VPU- og VPR-proteiner deltar i reguleringen av viral reproduksjon.
Antigene varianter av humant immunsviktvirus (HIV)
Humant immunsviktvirus (HIV) er svært variabelt. Selv fra kroppen til én pasient kan virusstammer isoleres som avviker betydelig i antigene egenskaper. Slik variasjon forenkles av den intensive ødeleggelsen av CD4+ celler og en kraftig antistoffrespons på HIV-infeksjon. En ny form for HIV, HIV-2, biologisk nær HIV-1, men immunologisk forskjellig fra den, har blitt isolert fra pasienter fra Vest-Afrika. Homologien til den primære strukturen til genomene til disse virusene er 42 %. DNA-proviruset HIV-2 inneholder 9671 bp, og dets LTR - 854 bp. HIV-2 ble senere isolert i andre regioner i verden. Det er ingen kryssimmunitet mellom HIV-1 og HIV-2. To store former for HIV-1 er kjent: O (Outlier) og M (Major), sistnevnte er delt inn i 10 undertyper (AJ). Åtte undertyper (AH) sirkulerer i Russland.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mekanismen for interaksjon mellom HIV og cellen
Etter å ha penetrert kroppen, angriper viruset først celler som inneholder CD4-reseptoren som er spesifikk for det. Denne reseptoren finnes i store mengder i T-hjelpere, i mindre mengder i makrofager og monocytter, og T-hjelpere er spesielt følsomme for viruset.
Humant immunsviktvirus (HIV) gjenkjenner CD4-reseptorer ved hjelp av sitt gpl20-protein. Prosessen med HIV-interaksjon med cellen skjer i henhold til følgende skjema: reseptormediert adsorpsjon -> belagt grop -> belagt vesikkel -> lysosom. I den smelter virionmembranen sammen med lysosommembranen, og nukleokapsidet, frigjort fra superkapsidet, går inn i cytoplasmaet; på vei til kjernen ødelegges det, og genomisk RNA og tilhørende kjernekomponenter frigjøres. Deretter syntetiserer revers transkriptase minustråden av DNA på virion-RNA, deretter ødelegger RNase H virion-RNA, og viral DNA-polymerase syntetiserer plusstråden av DNA. 5'-LTR og 3'-LTR dannes i endene av DNA-proviruset. DNA-proviruset kan forbli i kjernen en stund i inaktiv form, men før eller siden integreres det i kromosomet til målcellen ved hjelp av integrasen. I den forblir proviruset inaktivt inntil den gitte T-lymfocytten aktiveres av mikrobielle antigener eller andre immunkompetente celler. Aktivering av cellulær DNA-transkripsjon reguleres av en spesiell kjernefaktor (NF-kB). Det er et DNA-bindende protein og produseres i store mengder under aktivering og proliferasjon av T-lymfocytter og monocytter. Dette proteinet binder seg til visse sekvenser av cellulært DNA og lignende LTR-sekvenser av DNA-proviruset og induserer transkripsjon av både cellulært DNA og DNA-provirus. Ved å indusere transkripsjon av DNA-proviruset, utfører det overgangen av viruset fra en inaktiv tilstand til en aktiv, og følgelig fra en vedvarende infeksjon til en produktiv. Proviruset kan forbli i en inaktiv tilstand i svært lang tid. Aktivering av viruset er et kritisk øyeblikk i dets interaksjon med cellen.
Fra det øyeblikket viruset trenger inn i cellen, begynner perioden med HIV-infeksjon – virusbærertilstanden, som kan vare i 10 år eller mer; og fra det øyeblikket viruset aktiveres, begynner sykdommen – AIDS. Ved hjelp av sine regulatoriske gener og deres produkter begynner viruset å reprodusere seg aktivt. TAT-proteinet kan øke virusets reproduksjonshastighet med 1000 ganger. Viral transkripsjon er kompleks. Den inkluderer dannelse av både fullengdes og subgenomisk mRNA, mRNA-spleising, og deretter skjer syntesen av strukturelle og regulatoriske proteiner.
Syntese av strukturelle proteiner skjer som følger. Først syntetiseres Pr55Gag-forløperpolyproteinet (et protein med en molekylvekt på 55 kDa). Det inneholder fire hoveddomener: matriks (MA), kapsid (CA), nukleokapsid (NC) og rb-domenet, hvorfra de strukturelle proteinene p17, p24, p7 og rb dannes, som et resultat av kutting av Pr55Gag av viral protease (det er selvkuttet fra et annet forløperprotein, Gag-Pol). Dannelsen av Pr55Gag-polyproteinet er hovedbetingelsen for dannelsen av virale partikler. Det er dette proteinet som bestemmer virionets morfogeneseprogram. Det inkluderer sekvensielt stadiene for transport av Gag-polyproteinet til plasmamembranen, interaksjon med det og protein-protein-interaksjoner under dannelsen av viralpartikkelen og dens knoppskyting. Pr55Gag syntetiseres på frie polyribosomer; proteinmolekyler transporteres til membranen, hvor de forankres av sine hydrofobe regioner. CA-domenet spiller hovedrollen i å skape den native konformasjonen til Gag-proteinet. NC-domenet sikrer inkluderingen (ved hjelp av sine "sinkfingre") av 2 molekyler genomisk RNA i sammensetningen av den dannede viruspartikkelen. Polyproteinmolekylet dimeriserer initialt på grunn av samspillet mellom matriksdomenene. Deretter kombineres dimerene til heksameriske (av 6 enheter) komplekser som et resultat av samspillet mellom CA- og NC-domenene. Til slutt danner heksamerene, som forenes på sine laterale overflater, umodne sfæriske virioner, inni hvilke det genomiske virus-RNA-et er inneholdt, fanget av NC-domenet.
Et annet forløperprotein, Prl60Gag-Pol (et protein med en molekylvekt på 160 kDa), syntetiseres som et resultat av en rammeforskyvning av ribosomet under translasjon av 3'-enden av gag-genet i regionen som ligger umiddelbart oppstrøms for regionen som koder for rb-proteinet. Dette Gag-Pol-polyproteinet inneholder en ufullstendig Gag-proteinsekvens (1–423 aminosyrer) og Pol-sekvenser som inkluderer PR-, RT- og IN-domenene. Gag-Pol-polyproteinmolekyler syntetiseres også på frie polyribosomer og transporteres til plasmamembranen. Prl60Gagpol-polyproteinet inneholder alle de intermolekylære interaksjonsstedene og membranbindingsstedene som er iboende i Gag-polyproteinet. Derfor smelter Gag-Pol-polyproteinmolekylene sammen med membranen, og sammen med Gag-molekylene inkluderes de i de dannende virionene, noe som resulterer i fremveksten av aktiv protease og starten på virionmodningsprosessen. HIV-1-protease er kun svært aktiv i form av en dimer, derfor er dimerisering av disse molekylene nødvendig for å kunne fjerne dem fra Prl60Gag-Pol. Virionmodning består av at den frigjorte aktive proteasen kutter prl60Gag-Pol og Gag55 på stedene den gjenkjenner; proteinene p17, p24, p7, p6, revertase og integrase dannes, og de bindes til virusstrukturen.
Env-proteinet syntetiseres på ribosomer assosiert med membranene i det endoplasmatiske retikulum, deretter glykosyleres det, kuttes av en cellulær protease til gp120 og gp41, og transporteres til celleoverflaten. I dette tilfellet penetrerer gp41 membranen og binder seg til matriksdomenene til Gag-proteinmolekylet assosiert med den indre overflaten av membranen. Denne forbindelsen er bevart i det modne virionet.
Dermed består sammensetningen av viruspartikler av aggregering av forløperproteiner og tilhørende RNA-molekyler på plasmamembranen til vertscellen, dannelse av umodne virioner og deres frigjøring ved knoppskyting fra celleoverflaten. Under knoppskyting omgir virionet seg med en cellemembran hvor gp41- og gp120-molekylene er innebygd. Under knoppskyting, eller muligens etter frigjøring av virioner, skjer modningen deres, som utføres ved hjelp av en viral protease og består av proteolytisk kutting av forløperproteinene Pr55Gag og Prl60Gag-Pol til proteiner i det modne viruset og deres assosiasjon til visse strukturelle komplekser. Den ledende rollen i prosessene med viral morfogenese spilles av forløperpolyproteinet Pr55Gag, som organiserer og setter sammen det umodne virionet; modningsprosessen fullføres av en spesifikk viral protease.
Årsaker til immunsvikt
En av hovedårsakene til immunsvikt ved HIV-infeksjon er massedød av T-hjelpere. Det oppstår som et resultat av følgende hendelser. For det første dør T-hjelpere infisert med viruset på grunn av apoptose. Det antas at hos AIDS-pasienter er virusreplikasjon, apoptose og en reduksjon i antall T-hjelpere sammenkoblet. For det andre gjenkjenner og ødelegger T-drepere T-celler infisert med viruset eller som bærer adsorberte gpl20-molekyler, samt virusinfiserte og ikke-virusinfiserte T-hjelpere, som danner symplaster (syncytium) bestående av flere dusin celler (noen av dem dør som et resultat av reproduksjon av virus i dem). Som et resultat av ødeleggelsen av et stort antall T-hjelpere, er det en reduksjon i uttrykket av membranreseptorer i B-lymfocytter til interleukin-2, syntesen av forskjellige interleukiner (vekstfaktorer og differensiering av B-lymfocytter - IL-4, IL-5, IL-6, etc.) forstyrres, noe som resulterer i en forstyrrelse av funksjonen til T-drepersystemet. Aktiviteten til komplement- og makrofagsystemene undertrykkes. Makrofager og monocytter infisert med viruset dør ikke på lenge, men de er ikke i stand til å fjerne viruset fra kroppen. Til slutt, på grunn av den strukturelle og antigene likheten mellom gpl20 og reseptorene i noen epitelceller i kroppen (inkludert trofoblastreseptorer som medierer transplantasjonsoverføring av HIV), syntetiseres antireseptorantistoffer med et bredt spekter av virkning. Slike antistoffer er i stand til å blokkere forskjellige cellulære reseptorer og komplisere sykdomsforløpet med autoimmune lidelser. Konsekvensen av HIV-infeksjon er nederlag på alle hovedleddene i immunsystemet. Slike pasienter blir forsvarsløse mot et bredt spekter av mikroorganismer. Dette fører til utvikling av opportunistiske infeksjoner og svulster. For pasienter med HIV-infeksjon øker risikoen for å utvikle minst tre typer kreft: Kaposis sarkom; karsinom (inkludert hudkreft); B-celle lymfom, som oppstår på grunn av ondartet transformasjon av B-lymfocytter. HIV er imidlertid ikke bare lymfocytotropisk, men også nevrotropisk. Det trenger inn i cellene i sentralnervesystemet (astrocytter) både ved reseptormediert endocytose og ved fagocytose av virusinfiserte lymfoblaster av astrocytter. Når viruset interagerer med astrocytter, dannes det også symplaster, som letter spredningen av patogenet gjennom intercellulære kanaler. Viruset kan overleve i makrofager og monocytter i lang tid, slik at de fungerer som et reservoar og distributører av det i kroppen, og kan trenge inn i alt vev. Infiserte makrofager spiller en viktig rolle i introduksjonen av HIV i sentralnervesystemet og dets skade. Hos 10 % av pasientene er primære kliniske syndromer assosiert med skade på sentralnervesystemet og manifesterer seg som demens. Dermed er personer som er smittet med HIV karakterisert av 3 grupper av sykdommer - opportunistiske infeksjoner,svulstsykdommer og skade på sentralnervesystemet.
Epidemiologi av HIV-infeksjon
Kilden til HIV-infeksjon er kun en person - en syk person eller en virusbærer. Humant immunsviktvirus (HIV) finnes i blod, sædceller og livmorhalsvæske; hos ammende - i morsmelk. Smitte skjer seksuelt, gjennom blod og dets preparater, samt fra mor til barn før, under og etter fødsel. Tilfeller av infeksjon med viruset gjennom mat, drikke og insektbitt er ikke kjent.
Narkotikaavhengighet bidrar til spredning av AIDS. Forekomsten av HIV øker hvert år. Ifølge WHO var 58 millioner mennesker smittet med HIV fra 1980 til 2000. Bare i 2000 var 5,3 millioner mennesker smittet over hele verden, og 3 millioner mennesker døde av AIDS. Per 1. januar 2004 var 264 000 HIV-smittede registrert i Russland. Halvparten av de HIV-smittede dør innen 11–12 år fra smitteøyeblikket. Ved begynnelsen av 2004 levde omtrent 180 av hver 100 000 innbyggere i Russland med diagnosen "HIV-infeksjon". Det er spådd at med dette sykelighetsnivået vil det totale antallet HIV-smittede i Russland innen 2012 være 2,5–3 millioner mennesker. Kompleksiteten i kampen mot HIV-infeksjon avhenger av en rekke årsaker: for det første finnes det ingen effektive metoder for behandling og spesifikk forebygging; for det andre kan inkubasjonsperioden for HIV-infeksjon overstige 10 år. Varigheten avhenger av aktiveringsøyeblikket for T-lymfocytten og DNA-proviruset som finnes i kromosomet. Det er fortsatt uklart om alle som er smittet med viruset er dømt til AIDS, eller om langvarig bærerskap av viruset uten sykdom er mulig (noe som virker usannsynlig). Til slutt finnes det flere humane immunsviktvirus (HIV-1, HIV-2), hvis antigene forskjeller forhindrer dannelsen av kryssimmunitet. Oppdagelsen av simian immunsviktvirus (SIV) kastet lys over spørsmålet om HIVs opprinnelse. SIV ligner på HIV i sin genomorganisering, men skiller seg betydelig i sin nukleotidsekvens. HIV-2 inntar en mellomposisjon mellom HIV-1 og SIV i sine serologiske egenskaper, og er nærmere SIV i sin nukleotidsekvens. I denne forbindelse foreslo V.M. Zhdanov at HIV-1-, HIV-2- og SIV-virus stammer fra en felles stamfar. Det er mulig, ifølge R. Gallo, at en av SIV-ene på en eller annen måte kom inn i menneskekroppen, hvor den gjennomgikk en rekke mutasjoner, noe som resulterte i fremveksten av HIV-1, HIV-2 og dens andre former.
Symptomer på HIV-infeksjon
Humant immunsviktvirus har noen trekk som i stor grad bestemmer sykdommens patogenese. Viruset har en svært høy reproduksjonsrate, bestemt av dets regulatoriske elementer (opptil 5000 virioner syntetiseres på 5 minutter i aktiv fase). På grunn av tilstedeværelsen av fusjonsproteinet (gp41) induserer viruset dannelsen av omfattende syncytialstrukturer på grunn av fusjon av infiserte og uinfiserte T-hjelpere, noe som resulterer i deres massedød. gpl20-proteinmolekylene som dannes i store mengder sirkulerer fritt i blodet og binder seg til reseptorene til uinfiserte T-hjelpere, noe som resulterer i at de også gjenkjennes og ødelegges av T-drepere. Viruset kan spre seg gjennom intercellulære kanaler fra celle til celle, i hvilket tilfelle det blir dårlig tilgjengelig for antistoffer.
Kliniske kriterier for HIV-infeksjon
Hos voksne diagnostiseres HIV-infeksjon når de har minst to alvorlige symptomer i kombinasjon med minst ett mindre symptom og i fravær av andre kjente årsaker til immunsvikt (kreft, medfødt immunsvikt, alvorlig sult, osv.). Alvorlige symptomer inkluderer:
- vekttap på 10 % eller mer;
- en langvarig febertilstand, periodisk eller konstant;
- kronisk diaré.
Mindre symptomer: vedvarende hoste, generalisert dermatitt, tilbakevendende herpes zoster, oral og faryngeal candidiasis, kronisk herpes simplex, generalisert lymfadenopati. Diagnosen AIDS stilles kun ved Kaposis sarkom, kryptokokkmeningitt, pneumocystis-pneumoni. Det kliniske bildet av sykdommen påvirkes av den ledsagende opportunistiske infeksjonen.
Metoder for dyrking av humant immunsviktvirus (HIV)
HIV-1 og HIV-2 kan dyrkes i celler av kun én klon av TCV4-lymfocytter - H9, utvunnet fra leukemiske TCV4-lymfocytter. Monolagskulturer av astrocyttceller, der HIV-1 reproduserer seg godt, kan også brukes til disse formålene. Sjimpanser er mottakelige for HIV-1 blant dyr.
Virusets resistens i det ytre miljøet er lav. Det dør under påvirkning av sollys og UV-stråling, ødelegges ved 80 °C innen 30 minutter, og ved behandling med vanlige desinfeksjonsmidler - innen 20–30 minutter. For å desinfisere virusholdig materiale er det nødvendig å bruke mykobakteriedrepende desinfeksjonsmidler, siden de er effektive mot mikroorganismer med høyest resistens.
Laboratoriediagnostikk av HIV-infeksjon
Hovedmetoden for å diagnostisere virusbærerskap og HIV-infeksjon er enzymimmunoanalyse. På grunn av det faktum at gpl20 har strukturell og antigenlikhet med reseptorer i noen menneskelige celler, inkludert reseptorer som transporterer immunglobuliner gjennom epitelceller i slimhinnene, kan antistoffer relatert til antistoffer mot gpl20 forekomme i kroppen. I dette tilfellet kan det være falskt positive ELISA-resultater. Derfor gjennomgår alle positivt reagerende sera fra forsøkspersonene ytterligere analyse ved hjelp av immunoblotting-metoden, eller Western blotting. Denne metoden er basert på identifisering av antistoffene som studeres etter elektroforetisk separasjon og påfølgende testing ved bruk av merkede anti-artsantistoffer. Den virologiske metoden brukes sjelden på grunn av kompleksiteten ved å dyrke viruset. H9-lymfocyttklonen brukes til å oppnå virale antigener - de nødvendige komponentene i diagnostiske testsystemer. CPR-metoden tillater det å oppdage viruset i et tidlig stadium av viremi.
Behandling av HIV-infeksjon
Det er nødvendig å finne eller syntetisere legemidler som effektivt undertrykker aktiviteten til revers transkriptase (revertase) eller viral protease. De ville forhindre dannelsen av DNA-provirus og (eller) hemme intracellulær reproduksjon av viruset. Den moderne strategien for behandling av HIV-infiserte pasienter er basert på prinsippet om kombinert bruk av legemidler som hemmer viral protease (ett av legemidlene) og reversase (2 forskjellige legemidler) - kombinert (trippel) terapi. I Russland anbefales kombinert bruk av to innenlandske legemidler for behandling av HIV-infiserte pasienter: fosfazid og crixivan, som spesifikt undertrykker HIV-reproduksjon i tidlige og sene stadier av reproduksjon, spesielt med redusert aktivitet av azidotymidin.
Problemet med spesifikk profylakse er behovet for å lage en vaksine som sikrer dannelsen av effektiv cellemediert immunitet basert på virusspesifikke cytotoksiske lymfocytter uten noen betydelig produksjon av antistoffer. Slik immunitet gis av Thl-hjelpere. Det er mulig at antistoffer, inkludert virusnøytraliserende, ikke bare er ineffektive i å undertrykke HIV-infeksjon, men at de på et høyt nivå undertrykker cellemediert immunitet. Derfor må en anti-HIV-vaksine først og fremst oppfylle to hovedkrav: a) være helt trygg og b) stimulere aktiviteten til T-cytotoksiske lymfocytter. Effektiviteten til ulike vaksinevarianter oppnådd fra drepte (inaktiverte) virus og fra individuelle antigener med høye beskyttende egenskaper studeres. Slike antigener kan enten isoleres fra selve virionene eller syntetiseres kjemisk. En vaksine laget basert på genteknologiske metoder har blitt foreslått. Det er et rekombinant vacciniavirus som bærer HIV-gener som er ansvarlige for syntesen av antigener med sterke immunogene egenskaper. Spørsmålet om effektiviteten til disse vaksinene krever betydelig tid på grunn av den lange inkubasjonsperioden for HIV-infeksjon og den høye variasjonen til patogenet. Å utvikle en svært effektiv vaksine mot HIV er et presserende grunnleggende problem.

