Medisinsk ekspert av artikkelen
Nye publikasjoner
Spinal muskelatrofi
Sist anmeldt: 29.06.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Spinal muskelatrofi er ikke en enkeltstående nosologisk enhet, men en hel gruppe klinisk og genetisk heterogene arvelige patologier fremkalt av den økende degenerasjonen av motoriske nevroner i de fremre rygghornene. Begrepet omfatter ulike varianter av genetisk bestemt perifer parese og muskelatrofi som følge av degenerasjon av spinale motoriske nevroner og/eller hjernestamme. Den vanligste årsaken til problemet er en autosomal recessiv mutasjon på den lange q-skulderen på det femte kromosomet. Behandlingen er uspesifikk og tar sikte på å forbedre trofisiteten til nervevevet og gi palliativ støtte for å forbedre livskvaliteten. [ 1 ]
Epidemiologi
Spinal muskelatrofi forekommer i ett tilfelle per 6000 til 10 000 nyfødte (ifølge American Journal of Medical Genetics 2002).
Prevalensen av bærere av SMN-genet exon 7-delesjon er 1:50 personer.
Bulbo-spinal muskelatrofi (Kennedy syndrom) forekommer hos ett barn av 50 000 og er den vanligste typen spinal amyotrofi hos voksne.
Det bemerkes at halvparten av barna med denne sykdommen ikke overvinner den toårige overlevelsesperioden.
Patologien arves i henhold til det autosomalt recessive prinsippet. Oftest er hver forelder til et sykt barn bærer av én kopi av det muterte genet. Siden mutasjonen kompenseres for av tilstedeværelsen av en andre "normal" genkopi, har foreldrene ingen manifestasjoner av spinal muskelatrofi. Type 2-patologi arver vanligvis ikke en ekstra kopi fra forelderen. Problemet oppstår på grunn av en utilsiktet svikt under dannelsen av kimceller, eller direkte på tidspunktet for befruktning. Ved spinal muskelatrofi av den første typen forekommer spontan utvikling av sykdommen i bare 2 % av tilfellene (i denne situasjonen er bæreren bare én av foreldrene). [ 2 ]
Fører til spinal muskelatrofi
Hovedårsaken til spinal muskelatrofi er en mutasjon i genet som er ansvarlig for produksjonen av SMN-protein lokalisert på kromosom 5q. Denne lidelsen forårsaker videre gradvis død av motoriske nerveceller i de fremre hornene i ryggmargen og hjernestammen. Som et resultat av disse prosessene synker muskulaturen, og atrofi av respirasjons-, svelg-, ansikts- og skjelettmuskler utvikles. Den dominerende arvetypen for pediatriske former for spinal muskelatrofi er autosomal recessiv, som innebærer samtidig bærer av defekte gener hos begge foreldrene. Når det gjelder type IV-patologi (voksenform), er det en kobling til X-kromosomet, så bare menn er rammet.
Utviklingen av spinal muskelatrofi er basert på økende prosesser med degenerasjon og død av motoriske nevroner i ryggradens fremre horn, skade på hjernestammekjernene. Patologiske forandringer er mest intense i sonene med cervikal og lumbal fortykkelse. Celletallet reduseres til et minimum, erstatning med bindevev skjer, noe som skyldes svikt i celledødsprogrammet - den såkalte apoptose. Endringen påvirker strukturene til motorkjernene i kranialnervene, fremre røtter og motornervene. Det er en klinikk for nevrogen fascikulær atrofi. Ved et langvarig sykdomsforløp på et sent stadium oppstår overvekst av bindevev.
Utseendet av det tilsvarende kliniske bildet er assosiert med en mangel på SMN-proteinet, som påvirker den vellykkede funksjonen til motoriske nerveceller i de fremre rygghornene. Proteinmangel som en av leddene i utviklingen av spinal muskelatrofi ble oppdaget på slutten av 1900-tallet. På bakgrunn av motoriske nevronskader er innervasjonen av skjelettmuskulatur (hovedsakelig proksimale seksjoner) svekket. [ 3 ]
Risikofaktorer
Mangfoldet av kliniske former for spinal muskelatrofi 5q forklares av tilstedeværelsen av visse modifiserende faktorer som kan deles inn i to kategorier: de som påvirker og de som ikke påvirker SMN-proteinskåren.
- For tiden regnes SMN2-genet som den grunnleggende faktoren i utviklingen av spinal muskelatrofi: jo flere kopier av SMN2-genet, desto lavere er intensiteten av sykdomssymptomene. Den andre faktoren, som er direkte relatert til den sentromeriske kopien av SMN-genet, er en 1-nukleotid-substitusjon c.859G>C i ekson 7 av SMN2-genet, noe som fører til dannelsen av et nytt enhancer-bindings-spleisningssted: resultatet er inkluderingen av ekson 7 i transkriptet fra SMN2-genet. Denne variasjonen er assosiert med en økning i blodnivået av fullengdes SMN-protein hos pasienter med spinal amyotrofi av andre eller tredje type.
Andre faktorer som påvirker antallet SMN-er:
- Spleising-regulerende faktorer (Tra2β - induserer eksonhopping av ekson 7, SF2/ASF - øker ekson 7-inkludering, hnRNPA1 - undertrykker ekson 7-inkludering av SMN2-genet).
- Transkripsjonsregulerende faktorer (CREB1 - øker SMN-transkripsjon, STAT3 - favoriserer aksonvekst, IRF1 - øker antall SMN, PRL - øker levetiden i alvorlige stadier).
- MRNA-stabiliserende faktorer (U1A-reduserer SMN, HuR/p38).
- Faktorer som påvirker posttranslasjonell modifikasjon (RCA - undertrykker SMN-nedbrytning, GSK3 - øker overlevelse).
- Eksogene faktorer (sult, hypoksi, oksidativt stress).
Effektene av faktorene ovenfor ble hovedsakelig bestemt in vitro.
- Faktorer som ikke er assosiert med SMN-genet – spesielt proteiner som optimaliserer endocytose ved synapser (laminin 3, koronin, nevrokalsin delta, kalsium-neurin-lignende protein).
Ytterligere oppmerksomhet rettes mot DNA-metylering, den mest stabile modifikasjonen som påvirker genuttrykkets natur. Metyleringen av en gruppe gener som muligens er involvert i patogenetiske prosesser, ble funnet å være korrelert med alvorlighetsgraden av spinal muskelatrofi. [ 4 ]
Patogenesen
Spinal muskelatrofi er en genetisk patologi der alle typer arv – både autosomal dominant og autosomal recessiv eller X-bundet – er iboende. Oftest snakker vi om autosomal recessiv patologi i tidlig barndom. Ansvaret for dannelsen av slik spinal amyotrofi er SMN-genet, lokalisert i locus 5q13. Slettingen av exon 7 i SMN-genet resulterer i patologi med mulig involvering av de nærliggende genene p44 og NAIP.
SNM-genomet koder for et protein som inneholder 294 aminosyrer og har en MM på ~38 kDa. Proteinet har følgende funksjoner:
- Er en del av RNA-proteinkomplekset;
- Deltar i dannelsen av spliceosomstedet som katalyserer pre-RNA-spleising;
- Involvert i prosesser som kontrollerer proteinproduksjon og proteinisoformer;
- Sørger for aksonal transport av mRNA;
- Fremmer vekst av nerveceller og sørger for nevromuskulær kommunikasjon.
Et par typer SMN-gener er kjent:
- Telomerisk SMNt (SMN1);
- Sentromerisk SMNc (SMN2).
De aller fleste tilfeller av spinal muskelatrofi skyldes endringer i SMN1-genet.
Kennedy spinal muskelatrofi har en kobling til Xq12-lokuset som inneholder NR3C3-genet, som koder for et androgenreseptorprotein. Den har en X-bundet arvevariant. Når antallet CAG-repetisjoner i ett genekson øker, utvikler patologien seg.
Undertrykkelse av SNM-proteinproduksjon er ledsaget av følgende endringer:
- På grunn av svekket aksonkoordinasjon oppstår overdreven forgrening av aksoner;
- Veksten av aksoner avtar og størrelsen deres avtar;
- Det er feilaktig gruppering av kalsiumkanaler i vekstkjeglen;
- Uregelmessige presympatiske terminaler av motoriske nervecelleaksoner dannes.
Ryggmargen begynner aktivt å miste motoriske nevroner i de fremre hornene, noe som forklarer utviklingen av atrofi av musklene i de proksimale lemmene. [ 5 ]
Symptomer spinal muskelatrofi
Symptomatologi ved spinal muskelatrofi av Werdnig-Hoffman-typen debuterer oftest i nyfødtperioden og opptil seks måneder, manifestert av syndromet til en "treg" baby. Klokkeformet brystkasse, intens hypotoni, mangel på reflekser, muskelrykninger i tungen og pustevansker observeres. Syke spedbarn dør oftere før de fyller to år: dødelig utgang skyldes økende respirasjonssvikt på bakgrunn av vedvarende infeksjonsprosesser.
Den mellomliggende formen for spinal muskelatrofi av den andre typen oppdages fra seks måneders alder. I tillegg til syndromet til et "tregt" barn, er det lavt blodtrykk, mangel på reflekser, luftveisforstyrrelser og rykninger i tungen. Selv om barn klarer å sitte oppreist, utvikles det flere kontrakturer i de store leddene.
Kugelberg-Wielander spinal muskelatrofi starter også i tidlig barndom, med barn i stand til å bevege seg selvstendig. Det er svekkelse av iliac-, quadriceps- og adductor-musklene, lavt blodtrykk, reduserte reflekser og rykninger i tungen. Mange pasienter mister evnen til å bevege seg (gå) selvstendig over årene.
Spinal muskelatrofi type 4 starter i eldre alder. Den er karakterisert av langsom progresjon og en relativt godartet prognose. [ 6 ]
Kennedy-atrofi manifesterer seg oftest i middelalderen (kan vanligvis debutere hos pasienter i alderen 15–60 år). Symptomatologi inkluderer muskelsårhet og svakhet, gynekomasti, distal svakhet, sløvhet, rykninger i tungen og atrofi. Tegn på bulbær dysfunksjon er tilstede:
- Vanskeligheter med å svelge;
- Aspirasjon;
- Svekkelse av tyggemusklene;
- Dysartri;
- Posturale og motoriske skjelvinger i hendene.
Første tegn på androgenmangel:
- Gynekomasti (hos omtrent 60 % av pasientene), ofte asymmetrisk;
- Forverring av seksuell funksjon (oligospermi, testikkelatrofi, erektil dysfunksjon).
Første tegn
Spinal amyotrofi manifesterer seg ved muskelsvakhet og generell impotens. Alle sensoriske og intellektuelle evner påvirkes ikke.
Viktige indikatorer på nevromuskulær patologi:
- Muskulaturen er "lat", svekket, slapphet og slapphet i musklene er notert;
- Muskeltonus er lav, senereflekser er minimerte eller fraværende;
- Normale eller fraværende plantarreflekser;
- Korte rykninger i individuelle muskelgrupper er observert (kan sees under huden, på tungen);
- Det er tegn på muskelatrofi.
Werdnig-Hoffman syndrom manifesterer seg ved uttalt hypotoni i musklene, generell sløvhet, manglende evne hos barnet til å holde hodet, snu seg og sette seg opp. Når man prøver å støtte babyen i mageområdet i en svevende tilstand, ser det ut til at kroppen "synger". Hoste-, svelge- og sugerefleksen er utilfredsstillende, mat kommer ofte inn i luftveiene, pusten er problematisk. Det kan være leddforvrengning forbundet med intrauterin hypotoni. Anamnestisk informasjon samlet inn under graviditet indikerer ofte lav fosteraktivitet.
Grunnleggende tegn på spinal muskelatrofi type I:
- Alvorlig utviklingshemning i motorisk utvikling;
- Rask innsettende leddkontrakturer og thorakalkrumning;
- Økende luftveis- og bulbærforstyrrelser, problemer med å svelge (både mat og spytt) og opphosting av sputum;
- Økt risiko for aspirasjonsbetennelse;
- Infeksjon, progressiv respirasjonssvikt.
Spinal muskelatrofi type II manifesterer seg ved en tydelig hemming av motorisk utvikling. Selv om mange pasienter kan sitte uten hjelp, og noen ganger til og med krabbe og stå, går disse evnene ofte tapt over tid. Fingertremor, muskel- og ledd- (bein-) forvrengninger og respirasjonsproblemer observeres. Mulig pseudohypertrofi i legg.
Hovedtrekkene ved type II patologi:
- Utviklingsforsinkelser, inkludert å stoppe og reversere utviklingen av allerede tilegnede ferdigheter og evner;
- Økende svakhet i interkostalmusklene;
- Overfladisk diafragmatisk pust, svekket hosterefleks, gradvis forverring av respirasjonssvikt;
- Krumning av thorax og ryggsøyle, kontrakturer.
Ved Kugelberg-Wielander syndrom er manifestasjonene mildere og utvikler seg sakte. Pasienten er i stand til å bevege seg, men det er problemer med jogging eller trapper. Forsinkede symptomer inkluderer ofte vanskeligheter med å svelge og tygge.
Spinal muskelatrofi type IV viser seg allerede i eldre (voksen) alder og kjennetegnes av det mest "milde" og gunstige forløpet. Hovedtegnene: gradvis tap av evnen til å bevege seg. [ 7 ]
Skjemaer
Spinal muskelatrofi er en del av en gruppe arvelige patologier som er karakterisert av degenerative forandringer, død av motoriske nerveceller i de fremre rygghornene og ofte motorkjernene i hjernestammen. Prosessen kan gjøre seg gjeldende i ulike leveperioder, det kliniske bildet er ikke alltid det samme. Arvetypene og forløpet kan også variere.
Pediatrisk spinal muskelatrofi ble først beskrevet så tidlig som på slutten av 1800-tallet. Rundt midten av 1900-tallet ble de viktigste formene for sykdommen identifisert:
- Medfødt (manifesterer seg nesten umiddelbart etter fødselen av spedbarnet);
- Tidlig infantil form (oppstår mot bakgrunn av tidligere normal utvikling av babyen);
- Sen infantil form (avslører seg fra 2 år og eldre).
Noen spesialister kombinerer den andre og tredje formen til én pediatrisk type spinal amyotrofi.
Det er generelt akseptert å dele patologi inn i pediatrisk og voksen. Spinal muskelatrofi hos barn klassifiseres i tidlig (med debut i de første månedene etter barnets fødsel), sen og ungdomsår (ungdom eller juvenil). De vanligste syndromene er:
- Werdnig-Hoffman-atrofi;
- Kugelberg-Wielander-formen;
- Kronisk infantil spinal muskelatrofi;
- Vialetto-van Lare syndrom (bulbospinal type med fravær av hørsel);
- Fazio-Londe syndrom.
Spinal muskelatrofi hos voksne debuterer over 16 år og frem til omtrent 60 år, og kjennetegnes av en relativt godartet klinikk og prognose. Patologier hos voksne inkluderer:
- Kennedys bulbospinalatrofi;
- Scapuloperoneal atrofi;
- Ansikts-fang-skulder og okulo-faryngeale former;
- Distal spinal atrofi;
- Monomelisk spinalatrofi.
Separat separerer isolert og kombinert spinal atrofi. Isolert patologi er preget av overvekt av skade på spinale motoriske nevroner (som ofte er det eneste tegnet på problemet). Kombinert patologi er sjelden og representerer et kompleks av nevrologiske og somatiske lidelser. Det finnes beskrivelser av tilfeller av kombinert syndrom med medfødte koronar misdannelser, mangel på hørselsfunksjon, oligofreni, cerebellar hypoplasi.
Spinal muskelatrofi hos eldre er oftest representert ved Kennedy bulbospinal amyotrofi. Denne patologien arves recessivt X-bundet. Sykdomsforløpet er langsomt, relativt godartet. Den begynner med atrofi av den proksimale muskulaturen i underekstremitetene. Mulig tremor i hender, hode. Samtidig oppdages også endokrine problemer: testikkelatrofi, gynekomasti, diabetes mellitus. Til tross for dette, hos voksne, forløper patologien i en mildere form enn hos barn.
En variant av spinal muskelatrofi. |
Debuten av patologien |
Oppdagbart problem |
Dødens alder |
Karakteristisk symptomatologi |
Spinal muskelatrofi type 1 (annet navn Verding-Hoffman spinal muskelatrofi) |
Fra fødsel til seks måneder |
Babyen kan ikke sitte opp |
Opptil to år |
Alvorlig muskelsvakhet, hypotoni, problemer med å holde hodet oppe, nedsatt gråt og hoste, svelge- og spyttproblemer, utvikling av respirasjonssvikt og aspirasjonspneumoni |
Spinal muskelatrofi type 2 |
Seks måneder til halvannet år |
Babyen tåler ikke |
Mer enn to år |
Motorisk retardasjon, vekttap, hostesvakhet, håndskjelvinger, ryggkrumning, kontrakturer |
Spinal muskelatrofi type 3 (annet navn Kugelberg-Welander spinal muskelatrofi) |
Etter halvannet år. |
Kan i starten stå og gå, men ved en viss alder kan denne evnen gå tapt |
I voksen alder. |
Svekkede muskler, kontrakturer, hypermobilitet i ledd |
Spinal muskelatrofi type 4. |
Ungdomsår eller voksen alder |
Kan i starten stå og gå, men ved en viss alder kan denne evnen gå tapt |
I voksen alder. |
Økende proksimal muskelsvakhet, reduserte senereflekser, muskelrykninger (fascikulasjoner) |
Om distal spinal atrofi snakkes det om lesjoner i motoriske nerveceller i ryggmargen, som innerverer den nedre delen av kroppen. Karakteristiske tegn på slik patologi er:
- Atrofi av lårmusklene;
- Svakhet i knærne, fotstrekkerne og hofteadduktorene.
Ingen endring i senereflekser.
Distal spinal muskelatrofi er representert av to alleliske variasjoner med en overlappende fenotype:
- Scapulo-perineal spinal muskelatrofi;
- Arvelig motorisk-sensorisk nevropati av Charcot-Marie-Tooth type 2C.
Proksimal spinal muskelatrofi 5q er karakterisert ved økende symptomer på slapp lammelse og muskelatrofi, som skyldes degenerative forandringer i alfa-motorneuronene i de fremre rygghornene. Medfødt sykdom med postpartum asfyksi er den alvorligste formen: fra det øyeblikket barnet er født, er motorisk aktivitet praktisk talt fraværende, det er kontrakturer, svelging og respirasjonsproblemer. I de fleste tilfeller dør et slikt barn.
Komplikasjoner og konsekvenser
Videre progresjon av spinal amyotrofi fører til svakhet og reduksjon av muskelmasse i lemmene (spesielt bena). Babyen har i utgangspunktet ikke eller mister gradvis tilegnede ferdigheter – det vil si mister evnen til å gå og sitte uten støtte. Motorisk aktivitet i øvre lemmer avtar, leddene blir stive, over tid fester det seg kontrakturer, og ryggsøylen blir buet.
For å bevare motoriske evner så lenge som mulig og forhindre utvikling av komplikasjoner, anbefales det:
- Øv på riktig kroppsholdning (mot tyngdekraften), både i sengen og når du sitter, går osv.;
- Regelmessig fysioterapi, tøyningsøvelser, massasje, fysioterapi, uavhengig av type spinal muskelatrofi;
- Bruk spesielle senger, stoler (rullestoler), madrasser og puter;
- Velg og bruk støttende ortoser, korsetter;
- Øv på hydroterapi og kinesioterapi, som har en gunstig effekt på luftveiene, muskel- og skjelettsystemet og fordøyelsessystemet, nervesystemet og det kardiovaskulære systemet;
- Utføre regelmessige diagnostiske kontroller, inkludert kliniske tester, røntgenbilder av ryggraden og bekkenet;
- Konsulter systematisk en fysioterapeut og ortoped med erfaring i å jobbe med lignende pasienter;
- Juster korsetter, ortoser, ortopediske hjelpemidler, rullestoler osv. Avhengig av dynamikken.
Omsorgspersoner for en pasient med spinal muskelatrofi bør gjøres kjent med:
- Med det grunnleggende om trygg atferd, fysioterapi, massasje, fysioterapi;
- Med reglene for å opprettholde pasientens uavhengige aktivitet, bruk av ortopediske apparater;
- Med reglene for stell, hygiene.
Spinal amyotrofi kompliseres ofte av nedsatt tygging, svelging og ledning av mat, noe som truer aspirasjon og utvikling av aspirasjonsbetennelse i lungene eller obstruksjon av luftveiene, noe som er mest karakteristisk for patologien av den første typen. Svelgeproblemer viser seg ved symptomer som betydelig og vedvarende forlengelse av spiseperioden, motvilje mot å spise, mat som faller ut av munnen, regelmessig brekning og forverret vekttap.
Forstyrrelser i fordøyelsesmotilitet viser seg i forstoppelse, svak peristaltikk, langvarig matoppbevaring i magen (gastrisk stase), utvikling av gastroøsofageal refluks. For å forhindre slike komplikasjoner er det nødvendig:
- Overvåk pasientens riktige stilling mens han spiser;
- Bruk om nødvendig en magesond eller gastrostomi for å sikre tilstrekkelig væske- og næringsinntak og redusere risikoen for aspirasjon;
- Følg reglene for tilberedning av mat og drikke, pass på konsistensen og hyppigheten av måltidene;
- Avhengig av legens forskrivning, bruk medisiner, massasje, fysioterapi osv.
En av de alvorligste komplikasjonene ved spinal amyotrofi er dysfunksjon i respirasjonssystemet forbundet med svakhet i respirasjonsmusklene. Respirasjonsforstyrrelser kan være dødelige, både hos spedbarn med type 1-patologi og hos ungdoms- og voksne pasienter med type 2 eller 3-sykdom. Hovedproblemene er som følger:
- Hosterefleksen er forstyrret, det er problemer med oppspytt fra luftveiene;
- Økende underskudd i luftvolumet som kommer inn i lungene, nedsatt utskillelse av karbondioksid fra lungene;
- Forvrenger brystet, komprimerer og deformerer lungene;
- Infeksjonsfulle prosesser i form av bronkopneumoni.
For å forhindre slike komplikasjoner anbefales det ofte at pasienter utfører pusteøvelser ved hjelp av en Ambu-pose. [ 9 ]
Diagnostikk spinal muskelatrofi
Hos pasienter med mistanke om spinal amyotrofi er slike undersøkelser av diagnostisk verdi:
- Blodkjemi;
- Genetisk DNA-analyse;
- Elektroneuromyografi.
Blant tilleggsmetoder er det mulig å utnevne en biopsi av muskelfibre, ultralyd og resonansavbildning av muskulatur og hjerne.
Blodprøver kan indikere at kreatinfosfokinase er fysiologisk normal, men i noen tilfeller kan den være forhøyet til omtrent 2,5 ganger.
Elektroneuromyogrammet avslører endringer på grunn av tap av motoriske spinale nevroner. Dette oppdages ved en reduksjon i amplituden til interferenskurven, forekomsten av spontane aktive potensialer, som er flimmer og fasciokulasjoner som danner en spesifikk "frekvensrytme". Hastigheten på impulssignalet som passerer gjennom perifere motorfibre er normal eller redusert på grunn av sekundære denervasjonsforstyrrelser. [ 10 ]
Instrumentell diagnose er ofte også representert ved ultralyd eller MR av muskulaturen, som muliggjør deteksjon av muskelutskiftning med fettvev. MR avslører et typisk patologisk prosessmønster som er unikt for spinal muskelatrofi. Dette er imidlertid bare mulig i de sene stadiene av lesjonen.
I løpet av morfologisk analyse av muskelbiopsi hos pasienter bestemmes et uspesifikt bilde i form av buntatrofi og gruppering av muskelfibre. Det overveldende antallet berørte muskelfibre tilhører type 1, immunhistologiske og kjemiske egenskaper er innenfor normale grenser. Det ultrastrukturelle bildet er uspesifikt.
Den viktigste diagnostiske prosedyren for mistanke om spinal muskelatrofi er testing som kan oppdage SMN-genmutasjonen. Ved direkte DNA-analyse er det mulig å oppdage tilstedeværelse eller fravær av syvende og åttende ekson av SMNc- og SMNt-genene. Den mest informative metoden er kvantitativ analyse, som kan bestemme genkopietallet og belyse formen for spinal muskelatrofi. Den kvantitative metoden er også viktig for å vurdere pasientens status. Det er et nødvendig tiltak som utføres for videre medisinsk og genetisk familieveiledning.
Ytterligere diagnostiske tester utføres kun etter at et negativt resultat av SMN-gendelesjon er oppnådd. Hvis deteksjon av punktmutasjoner er nødvendig, kan direkte automatisert sekvensering av SMNt-genet brukes.
Differensiell diagnose
Differensialdiagnosen stilles ved patologiske prosesser som avslører symptomkomplekset til en "treg pasient", medfødt muskeldystrofi, strukturell eller mitokondriell myopati. Spesielt bør tilstedeværelsen av slike patologier utelukkes:
- Motorisk nevronsykdom;
- Primær lateral myosklerose;
- Muskeldystrofi;
- Medfødte myopatier;
- Sykdommer forbundet med glykogenopphopning;
- Polio;
- Autoimmun myasthenia gravis.
Diagnosealgoritmen utvikles avhengig av de særegne symptomene hos et bestemt barn. Derfor brukes en spesiell klassifisering av pasienter, avhengig av funksjonell status (Europrotocol TREAT-NMD):
- Klarer ikke å sitte oppreist uten støtte (sengeliggende).
- Kan sitte, men kan ikke gå (stillesittende).
- I stand til å bevege seg selvstendig (gå pasienter).
Følgende diagnostiske algoritme anbefales for pasienter i den første gruppen:
- Fysisk undersøkelse (påvisning av brystkrumning, vurdering av respirasjons- og hostefunksjon og hudtilstand);
- Hjerte- og respirasjonsmonitorering, polysomnografi og identifisering av symptomer på pulmonal ventilasjonsunderskudd;
- Pulsoksimetri for å bestemme graden av oksygenering;
- Vurdering av hyppigheten av infeksiøse og inflammatoriske patologier og antibiotikakurer i løpet av den ekstreme seksmånedersperioden;
- Røntgen av brystet med gjentatte dynamiske studier;
- Vurdering av svelgefunksjon.
For pasienter i den andre gruppen gjelder følgende algoritme:
- Fysisk undersøkelse;
- Hjerte- og respirasjonsovervåking, polysomnografi for å oppdage pulmonalt ventilasjonsunderskudd;
- Pulsoksimetri;
- Vurdering av hyppigheten av infeksjons- og inflammatoriske prosesser og antibiotikakurer i løpet av den ekstreme seksmånedersperioden;
- Undersøkelse av ryggsøylen, røntgenbilder av ryggraden, vurdering av krumningsgrad.
Pasienter i den tredje gruppen er indisert for slike studier:
- Fysisk undersøkelse;
- Testing av respirasjonsfunksjon (inkluderer spirometri, beregning av lungevolum, vurdering av respirasjonsmuskelfunksjon);
- For å finne ut hyppigheten av infeksjons- og inflammatoriske patologier og antibiotikakurer i løpet av den ekstreme årstiden.
Differensialdiagnostikk kan kompliseres av likheten mellom SMN1- og SMN2-genene. For å unngå feil anbefales det å bruke MLPA-metoden, som gjør det mulig å detektere kopitallet av ekson 7 i SMN1-genet.
I de fleste tilfeller av spinal muskelatrofi er det en homozygot delesjon av ekson 7 og/eller 8 i SMN1-genet. Imidlertid kan andre gener (ATP7A, DCTN1, UBA1, BSCL2, EXOSC3, GARS, etc.) også være "syndere", noe man bør være oppmerksom på hvis SMN1-testen er negativ.
Biomaterialet for studien kan være perifert blod eller fosterblod, kart over tørre blodflekker. Diagnose er obligatorisk:
- Ved forverret spinal muskelatrofi i sykehistorien;
- Når mistenkelige symptomer oppdages, uavhengig av arvelig historie.
I tillegg anbefales forskning også for alle par som er ansvarlige i planleggingen av et svangerskap.
Hvem skal kontakte?
Behandling spinal muskelatrofi
Pasienter med spinal muskelatrofi trenger omfattende behandling som inkluderer:
- Omsorg, hjelp, støtte;
- Diettmat;
- Medikamentell behandling;
- Ikke-medikamentelle rehabiliteringstiltak, inkludert kinesioterapi og fysioterapi.
Et terapeutisk regime som involverer en polymodal effekt på alle kroppssystemer, ikke bare muskel- og skjelettsystemet, er standard.
Dessverre er det umulig å kurere spinal muskelatrofi radikalt. Men det er ofte mulig å forbedre pasientens livskvalitet gjennom kompetent bruk av aminosyrer og multivitaminkomplekser, nevrotrofiske midler, kalsiumkanalblokkere, vasodilatorer, kardiotrofiske og cytostatiske legemidler, proteasehemmere, steroide legemidler, antioksidanter, immunglobuliner og immunsuppressiva, og så videre. Det er eksperimentelt bevist at behandling med stamceller, nevrobeskyttende forbindelser og muskelstyrkende molekyler kan føre til uforutsigbare systemiske lidelser. Samtidig er det ikke bevist positiv dynamikk etter bruk av slik behandling så langt.
Siden problemet skyldes mangel på normalt SMN-protein, kan pasientenes tilstand forbedres ved å øke SMN-proteinnivåene med 25 % eller mer. Av denne grunn forskes det aktivt på legemidler som kan aktivere produksjonen av dette proteinet, inkludert Gabapentin, Riluzole, Hydroxyurea, Albuterol, valproinsyre og natriumfenylbutyrat.
Moderne medisin tilbyr også kirurgisk behandling for spinal muskelatrofi. Den består av kirurgisk justering av ryggsøylen - korrigering av nevromuskulær krumning. Kirurger utfører flernivåfiksering av ryggsøylen ved hjelp av spesielle konstruksjoner. Korsbenet, bekkenet og ryggvirvlene i øvre brystvirvler eller andre ryggvirvler brukes som støttepunkter. Kirurgien bidrar til å rette opp ryggsøylen, fordele belastningen jevnt på den, eliminere ubehag ved endring av kroppens stilling og unngå negative effekter på indre organer (inkludert lungene).
Medisiner
For tiden finnes det ingen etiologisk behandling for spinal muskelatrofi: vitenskapelig medisin fortsetter å jobbe med denne oppgaven. Tidligere har forskere allerede lyktes med å isolere legemidler som kan øke produksjonen av mRNA fra SMN2-genet. Men store internasjonale kliniske studier som involverer personer med spinal muskelatrofi har ennå ikke blitt utført.
De fleste legemidlene som inngår i standardbehandlingsregime har et generelt virkningsprinsipp med relativt lav evidens for effekt.
L-karnitin |
En naturlig forekommende aminosyre, en "slektning" av B-vitaminene. Den produseres i kroppen, finnes i leveren og tverrstripete muskler, tilhører en rekke vitaminlignende stoffer. Deltar i metabolske prosesser, støtter CoA-aktivitet, brukes til å normalisere metabolismen. Den har anabole, antityreoidea, antihypoksiske evner, stimulerer lipidmetabolisme og vevsreparasjon, optimaliserer appetitten. L-karnitin foreskrives i en mengde på omtrent 1000 mg per dag. Behandlingsforløpet kan vare i opptil 2 måneder. |
Koenzym Q10 (ubikinon) |
En koenzym-benzokinongruppe som inneholder en rekke isoprenylgrupper. Dette er fettløselige koenzymer, hovedsakelig tilstede i mitokondrier i eukaryote cellestrukturer. Ubikinon er inkludert i elektrontransportkjeden og deltar i oksidativ fosforylering. Stoffet finnes i størst mulig mengde i energirike organer – spesielt i lever og hjerte. Koenzym Q10 har blant annet antioksidantegenskaper og kan gjenopprette antioksidantkapasiteten til alfa-tokoferol. Vanligvis foreskrives 30 til 90 mg av legemidlet per dag, en tomåneders kur. |
Cerebrolysin |
Et nootropisk legemiddel med nevrotrofiske egenskaper. Det brukes ofte i terapeutiske regimer for behandling av nevrologiske patologier, inkludert vaskulær demens og hjerneslag. Den aktive fraksjonen inneholder peptider med en begrensende molekylvekt på 10 tusen dalton. Legemidlet administreres som en intravenøs injeksjon på 1-2 ml. Behandlingsforløpet består av 10-15 injeksjoner. |
Actovegin |
Legemidlets sammensetning er representert av lavmolekylære peptider og aminosyrederivater. Actovegin er et hemoderivativ: det isoleres ved dialyse med ultrafiltrering. Takket være bruken av legemidlet økes absorpsjonen og utnyttelsen av oksygen, energimetabolismen akselereres. Legemidlet brukes i form av intravenøse injeksjoner på 1-2 ml, forløpet krever 10-15 injeksjoner. |
Solkoseryl |
Det er et deproteinisert hemodialysat som er i stand til å optimalisere precellulær oksygen- og glukosetransport, forbedre intracellulær ATP-produksjon, stimulere regenerative vevsreaksjoner, aktivere fibroblastproliferasjon og kollagenproduksjon i karveggene. Behandlingsforløpet består av 10–15 intramuskulære injeksjoner av legemidlet (1–2 ml daglig). |
Neuromultivit (vitamin B-kompleks) |
Multivitamin, aktivt brukt ved mangel på vitamin B-gruppen. Det kan ofte bli en god erstatning for injeksjoner med vitaminpreparater. Aktiverer metabolske prosesser i hjernen, fremmer gjenoppretting av vev i nervesystemet og har en smertestillende effekt. Neuromultivit tas 1-2 tabletter daglig, i en kur på 4 eller 8 uker. |
E-vitamin |
En velkjent antioksidant, fettløselig vitamin. Det foreskrives i kurer på 1-2 måneder i mengden 10-20 IE daglig. |
Valproat |
De har beroligende og avslappende aktivitet, viser antikonvulsiv evne og øker nivået av GABA i sentralnervesystemet. Brukes kun til behandling av barn over ett år, 10 til 20 mg per kg per dag. |
Salbutamol |
En bronkodilatator, som tilhører gruppen selektive beta2-adrenoreseptoragonister. Regelmessig bruk av legemidlet forårsaker økt produksjon av mRNA og SMN-protein, noe som påvirker det kliniske bildet av spinal muskelatrofi positivt. Salbutamol brukes med forsiktighet, 2–4 mg fire ganger daglig (maksimal mengde er 32 mg per dag). |
Et av de nyeste legemidlene som brukes ved spinal muskelatrofi er det genoterapeutiske legemidlet Zolgensma, som sikrer aktivitet og korrekt funksjon av transduserte motoriske nerveceller. Legemidlet administreres i kombinasjon med immunmodulerende legemidler i henhold til en spesiell protokoll og administreres én gang intravenøst, basert på en nominell dose på 1,1 ͯ 1014 Vg/kg (det totale administrasjonsvolumet bestemmes avhengig av pasientens vekt).
Før oppstart av behandling med Zolgensma er det obligatorisk å bestemme nivået av antistoffer mot AAV9 ved hjelp av en validert diagnostisk metode, vurdere leverfunksjon (ALAT, ASAT, total bilirubin), utføre en generell klinisk blodprøve og troponin I-test, bestemme kreatininnivået. Hvis akutte og kroniske aktive infeksjonstilstander oppdages, utsettes administrering av legemidlet til helbredelse eller fullføring av tilbakefallsfasen av den infeksjonsprosessen.
Den hyppigste bivirkningen av legemidlet anses å være leversvikt, som kan være dødelig.
Andre godkjente medisiner legen din kan foreskrive for spinal muskelatrofi:
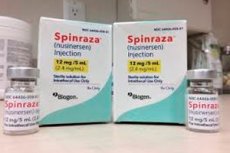
- Spinraza er et preparat av nusinersen-natrium, et antisense-oligonukleotid spesielt utviklet for behandling av spinal amyotrofi. Det er beregnet for intratekal administrering ved lumbalpunksjon. Anbefalt dose er 12 mg. Behandlingsregimet bestemmes av behandlende lege.
- Risdiplam er et legemiddel som modifiserer spleising av mRNA-forløperen til motornervecelleoverlevelsesgen 2. Risdiplam tas oralt én gang daglig. Doseringen bestemmes individuelt av legen, tatt i betraktning pasientens alder og vekt. Bruk av legemidlet hos barn under 2 måneder er kontraindisert. Embryofetal toksisitet av dette legemidlet er observert, så reproduktive potensielle pasienter bør bruke nøye prevensjon både under og i en periode etter behandlingen.
Fysioterapeutisk behandling for spinal muskelatrofi
Fysioterapi brukes som et av leddene i kompleks terapi og rehabilitering av pasienter med spinal muskelatrofi. Hovedpunktene i slik behandling er:
- Bruk av avlastning ved hjelp av opphengssystemer, aktiv-passiv trening, bruk av perkutan elektrisk stimulering av ryggmargen;
- Pusteøvelser og fysioterapi;
- Halvtimes vertikaliseringsøkter;
- Translingual elektrostimuleringsbehandling (20-minutters økter, kombinert med øvelser for å forbedre finmotorikken);
- Manuelle teknikker;
- Parafinpåføringer på ulike grupper av artikulasjoner;
- Darsonval for å forbedre muskelytelsen.
Darsonvaliseringsmetoden er basert på effekten på vev ved bruk av en vekslende høyfrekvent pulsstrøm med høy spenning og lav styrke. Etter et behandlingsforløp er det en økning i muskelytelse, styrking av mikrosirkulasjon, utvidelse av arterioler og kapillærer, eliminering av iskemi, forbedring av ernæring og oksygentilførsel til muskler, noe som har en positiv effekt på forløpet av regenerative og atrofiske prosesser.
Et av de viktigste problemene hos pasienter med spinal amyotrofi er svakhet i respirasjonsmusklene, som ofte fører til respirasjonsdysfunksjon og pasientens død.
Ved spinal amyotrofi fungerer hele skjelettmuskulaturen, inkludert den som er ansvarlig for pusten, dårlig. Svakhet og gradvis muskelatrofi påvirker kvaliteten på respirasjonsprosessen negativt, fører til utvikling av komplikasjoner og økende respirasjonssvikt. Derfor er det nødvendig å iverksette tiltak for å styrke musklene, forebygge respirasjonskomplikasjoner og luftveisinfeksjoner. En spesiell rolle i dette spiller gymnastikk med Ambu-posen, som utføres i forbindelse med fysioterapi, tøyningsøvelser og massasje. Bruken av Ambu-posen lar deg "utvide" volumet av brystkassen og lungene. For barneaktiviteter er en pose med et volum på minst halvannen liter egnet, utstyrt med en ventil for å frigjøre for høyt trykk (for å forhindre barotraume).
Øvelser bør ikke utføres på full mage. Kroppsstilling - sittende, halvsittende, liggende på siden eller ryggen (hvis det ikke er problemer med slim): det er optimalt å utføre prosedyrene i forskjellige stillinger hver gang. Det er viktig at pasientens rygg er rettet. Om nødvendig brukes korsett. Før prosedyren starter, sørg for at luftveiene er fri for sputum.
Massasje for spinal muskelatrofi
Massasje for behandling av spinal amyotrofi bør være lett og skånsom. I områder med muskelmotstand bør generelle effekter, inkludert tapping, og i områder med bevart innervasjon, bruk dype strøk (langsgående, tverrgående) og elting.
Generelt sett praktiseres ulike typer massasje, avhengig av de individuelle egenskapene til sykdomsforløpet og pasientens alder. Disse kan være:
- Elting for å stimulere dyptliggende muskler;
- Gnier for å optimalisere blod- og lymfesirkulasjonen;
- Punktbehandling av triggerpunkter;
- Av den fiberforsterkende bankingen.
Det er viktig at effekten spres over hele problemområdet.
Kontraindikasjoner for massasje ved spinal muskelatrofi:
- Akutt betennelse, forhøyet kroppstemperatur;
- Blodsykdommer, blødningstendenser;
- Purulente prosesser;
- Infeksjonssykdommer, soppsykdommer i dermatologi;
- Vaskulære aneurismer, trombangitt, endarteritt, lymfadenitt;
- Godartede og ondartede neoplasmer.
Massasjeforløpet for en pasient med spinal muskelatrofi foreskrives strengt individuelt. Feil utførelse av prosedyren, for hard og upassende belastning kan skade pasientens tilstand.
Forebygging
Direkte og indirekte DNA-diagnostikk og prenatal DNA-diagnostikk forfølges nå aktivt. Dette reduserer sannsynligheten for at et sykt barn blir født betydelig, noe som er spesielt viktig for par som allerede har opplevd fødselen av barn med spinal muskelatrofi.
Forebyggende tiltak representerer en viktig medisinsk trend og er kategorisert i primære, sekundære og tertiære tiltak.
Primære tiltak er rettet mot å direkte forhindre påvirkning av en ugunstig faktor og forhindre utviklingen av sykdommen. Slik forebygging består i å korrigere kosthold og daglig rutine, og føre en sunn livsstil.
Sekundærforebygging består i å eliminere åpenbare risikofaktorer og inkluderer tidlig diagnose av patologier, etablering av dynamisk overvåking og målrettet behandling.
Tertiær forebygging utføres i forhold til en syk person som er fratatt visse motoriske evner. I denne situasjonen snakker vi om medisinering, psykologisk, sosial og arbeidsrehabilitering.
Ifølge informasjon fra Verdens helseorganisasjon blir mer enn 2 % av babyer i verden født med en eller annen form for utviklingsforstyrrelse. Samtidig er 0,5–1 % av slike lidelser av genetisk opprinnelse. Forebygging av slike problemer er redusert til medisinsk genetisk rådgivning og kvalifisert prenatal diagnostikk, noe som gjør det mulig å minimere risikoen for å føde et barn med genetisk patologi.
En persons risiko for å få spinal muskelatrofi eller en annen genetisk sykdom avhenger av genene som er arvet fra mor og far. Tidlig identifisering av arvelige faktorer og beregning av individuell risiko for genetisk bestemt patologi kan kalles en metode for målrettet forebygging.
Prenataldiagnostiske tiltak inkluderer direkte og indirekte forskningsmetoder. I utgangspunktet identifiseres kvinner som trenger indirekte prenataldiagnostikk. Disse kan omfatte:
- Gravide kvinner 35 år og eldre;
- Som har hatt 2 eller flere tidligere spontanaborter;
- Som har barn med genetiske utviklingsdefekter;
- Med en ugunstig arvelig historie;
- Som har hatt virusinfeksjoner eller blitt eksponert for stråling (inkludert i planleggingsfasen av graviditeten).
For forebyggende formål brukes metoder som ultralyd og hormontester (biokjemisk screening). Noen ganger brukes også invasive prosedyrer som korionbiopsi, fostervannsprøve, placentocentese og kordocentese. Pålitelig informasjon om genetiske risikoer lar deg justere livsstil og graviditet for å forhindre fødsel av et sykt barn.
Vaksine mot spinal muskelatrofi
Selvfølgelig ønsker alle foreldre til barn med spinal amyotrofi å kurere dem fullstendig for sykdommen. Det finnes imidlertid ingen vaksine som kan utrydde problemet, selv om forskning på optimalisering av behandlingen pågår.
Spesielt godkjente amerikanske forskere i 2016 det unike legemidlet Spinraza (nusinersen), som senere ble godkjent for bruk i europeiske land.
Spesialister undersøker problemet med å behandle spinal muskelatrofi på disse måtene:
- Å fikse eller erstatte det "feil" SMN1-genet;
- Potensiering av funksjonen til det normale SMN2-genet;
- Beskyttelse av motoriske nerveceller som er påvirket av SMN-proteinmangel;
- Beskyttelse av muskler mot atrofiske forandringer for å forhindre eller gjenopprette tapt funksjon mot bakgrunnen av patologisk utvikling.
Genterapi innebærer å målrette det skadede genet ved hjelp av virale vektorer som passerer gjennom blod-hjerne-membranen og når det aktuelle området i ryggmargen. Deretter «infiserer» viruset den berørte cellen med en frisk DNA-del, som om det «sutur» genfeilen. Dermed korrigeres funksjonen til motoriske nerveceller.
En annen retning er småmolekylterapi, hvis essens er å forbedre funksjonen til SMN2-genet. Spedbarn med diagnostisert spinal muskelatrofi har minst én kopi av SMN2-genet. Denne retningen har blitt aktivt forsket på av amerikanske forskere, og for øyeblikket gjennomgår flere medisiner som tar sikte på å forbedre syntesen av et komplett protein fra SMN2-genet kliniske studier.
En annen mulighet for terapeutisk intervensjon er å utforske nevrobeskyttelse for å redusere død av motoriske nevroner, øke deres tilpasningsevne og forbedre funksjonalitet.
Den tredje retningen innebærer å beskytte muskelen mot atrofiske prosesser. Siden SMN-proteinmangel påvirker motoriske nerveceller og muskelfunksjon negativt, bør målet med denne behandlingen være å beskytte musklene mot atrofi, øke muskelmassen og gjenopprette muskelfunksjonen. Denne typen terapi vil ikke påvirke det genetiske apparatet, men den kan bremse eller til og med blokkere forverringen av spinal muskelatrofi.
Screening for spinal muskelatrofi
Nyfødtscreening brukes i økende grad i medisinsk praksis og spiller ofte en avgjørende rolle. Å oppdage spinal muskelatrofi så tidlig som mulig kan forbedre prognosen for det syke barnet betydelig. Screeningdiagnostikk inkluderer følgende punkter skissert i tabellen:
En form for spinal muskelatrofi |
Symptomatologi |
Spinal muskelatrofi type I (barnet kan ikke sitte oppreist, gjennomsnittlig levealder - opptil 2 år) |
Det manifesterer seg fra fødselen til seks måneder. Utilstrekkelig muskeltonus oppdages, gråten er svak, muskelsvakhet (inkludert tygge- og svelgemuskler) øker. Det er problemer med hodebevaring, babyen inntar en "froske"-holdning når den ligger ned. |
Spinal muskelatrofi type II (barnet er i stand til å sitte oppreist, forventet levealder er vanligvis mer enn 2 år, og mer enn halvparten av pasientene lever til de blir 20–25 år gamle) |
Den debuterer fra 7 måneders alder og opp til halvannet år. Svelging-, puste- og hosteproblemer observeres noen ganger. Permanente tegn inkluderer muskelspasmer, begrenset leddmobilitet, krumning av ryggsøylen, lavt blodtrykk og muskelsvakhet. |
Spinal muskelatrofi type III (barnet kan sitte og bevege seg, men ovennevnte evner går gradvis tapt, forventet levealder er normal) |
Debuterer i en alder av halvannet år. Krumning av ryggsøylen og thorax, muskelatrofi i bekkenet og de proksimale bena, og økt leddmobilitet er observert. Svelging er vanskelig. |
Spinal muskelatrofi type IV |
Refererer til voksenformen. Symptomatologien har mye til felles med spinal muskelatrofi type III. Svakheten øker gradvis, tremor og muskelfasciokulasjoner oppstår med debut i alderen 16–25 år. |
Prognose
Ved Werdnig-Hoffman syndrom er gjennomsnittlig levealder 1,5–2 år. Dødelig utgang skyldes i de fleste tilfeller økende respirasjonssvikt og utvikling av betennelse i lungene. Med rettidig respiratorisk støtte i form av kunstig ventilasjon er det mulig å øke babyens levealder noe. Det er et spesielt behov for kontinuerlig palliativ behandling, som også er nødvendig ved spinal amyotrofi type II. Patologier av tredje og fjerde type er preget av en gunstigere prognose.
Enhver type spinal muskelatrofi er en alvorlig sykdom. Alle familiemedlemmer til pasienten trenger konstant psykologisk, informativ og sosial støtte. Det er viktig for pasienten å sikre tilstrekkelig diagnose og profesjonell støtte fra spesialister som barnelege, nevrolog, pulmonolog, kardiolog, ortoped, fysioterapeut, etc. Til tross for mangelen på spesifikk terapi for sykdommen, utføres symptomatisk behandling, spesiell ernæring foreskrives (både parenteral og enteral), og ulike rehabiliteringstiltak bidrar til å bremse utviklingen av patologien og forhindre komplikasjoner.
Mange pasienter får innvilget en funksjonshemming, og det utarbeides en individuell rehabiliteringsplan.
Naturlig forekommende spinal muskelatrofi uten bruk av spesialutstyr for å støtte pust og mating ender i omtrent halvparten av tilfellene med at det syke barnet dør før det fyller to år (for det meste type I sykdom).

