Medisinsk ekspert av artikkelen
Nye publikasjoner
Eggstokk
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
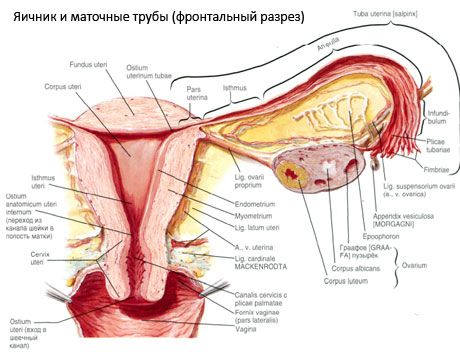
Eggstokken (ovarium; gresk oophoron) er et paret organ, en kvinnelig reproduksjonskjertel, som ligger i bekkenhulen bak livmorens brede ligament. I eggstokkene utvikles og modnes kvinnelige reproduksjonsceller (egg), og det dannes kvinnelige kjønnshormoner som kommer inn i blodet og lymfen. Eggstokken har en eggformet form, noe flatet i anteroposterior retning. Fargen på eggstokken er rosa. På overflaten av eggstokken til en kvinne som har født, er fordypninger og arr synlige - spor etter eggløsning og transformasjon av corpora lutea. Eggstokken veier 5-8 g. Dimensjonene på eggstokken er: lengde 2,5-5,5 cm, bredde 1,5-3,0 cm, tykkelse - opptil 2 cm. Eggstokken har to frie flater: den mediale flaten (facies medialis), som vender mot bekkenhulen, delvis dekket av egglederen, og den laterale flaten (facies lateralis), som grenser til bekkenets sidevegg, til en lett uttrykt fordypning - eggstokkfossa. Denne groben ligger i vinkelen mellom de ytre iliackarene dekket med peritoneum øverst og livmor- og obturatorarteriene nederst. Bak eggstokken går urinlederen på den tilsvarende siden retroperitonealt ovenfra og ned.
Overflatene på eggstokken går over i en konveks fri (bakre) kant (margo liber), foran - i mesenterialkanten (margo mesovaricus), festet ved hjelp av en kort fold av peritoneum (eggstokkmesenteriet) til den bakre klaffen på livmorens brede ligament. På denne fremre kanten av organet er det en rillet fordypning - eggstokkens hilum (hilum ovarii), hvor arterien og nervene går inn i eggstokken, og venene og lymfekarene går ut. Eggstokken har også to ender: den avrundede øvre rørformede enden (extremitas tubaria), som vender mot egglederen, og den nedre livmorenden (extremitas utenna), som er forbundet med livmoren med eggstokkens ligament (lig. ovarii proprium). Dette ligamentet, i form av en rund snor på omtrent 6 mm tykkelse, går fra livmorenden av eggstokken til den laterale vinkelen på livmoren, som ligger mellom de to klaffene på livmorens brede ligament. Eggstokkens ligamentapparat inkluderer også eggstokkens opphengsledd (lig.suspensorium ovarii), som er en fold av bukhinnen som går fra bekkenveggen til eggstokken og inneholder eggstokkkarene og bunter av fiberfibre inni. Eggstokken er festet av et kort mesenterium (mesovarium), som er en duplikat av bukhinnen som går fra den bakre klaffen av livmorens brede ligament til eggstokkens mesenteriske kant. Selve eggstokkene er ikke dekket av bukhinnen. Den største eggstokkkanten av egglederen er festet til den rørformede enden av eggstokken. Eggstokkens topografi avhenger av livmorens plassering og dens størrelse (under graviditet). Eggstokkene er svært mobile organer i det lille bekkenhulen.
Kar og nerver i eggstokken
Blodforsyningen til eggstokkene dekkes av aa. et vv. ovaricae et uterinae. Begge eggstokkarteriene (aa. ovaricae dextra et sinistra) utgår fra den fremre overflaten av aorta rett under nyrearteriene; den høyre utgår vanligvis fra aorta, og den venstre fra nyrearterien. Hver eggstokkarterie peker nedover og lateralt langs den fremre overflaten av psoas major-muskelen, og krysser ureteret foran (og avgir grener til den), de ytre iliackarene, grenselinjen og går inn i bekkenhulen, og befinner seg her i eggstokkens opphengsligament. I medial retning passerer eggstokkarterien mellom bladene på det brede ligamentet i livmoren under egglederen, avgir grener til den, og deretter inn i eggstokkens mesenterium; den går inn i eggstokkens hilum.
Grenene til arteria ovaria ligger i vid anastomose med grenene til arteria uterina. Venøs utstrømning fra eggstokkene skjer primært inn i den venøse plexus ovaria, som ligger i regionen av ovariehilum. Herfra går blodet i to retninger: gjennom livmor- og eggstokkvenene. Den høyre eggstokkvenen har klaffer og renner ut i den nedre hulvenen. Den venstre eggstokkvenen renner ut i venstre nyrevene, selv om den ikke har klaffer.
Lymfedrenasje fra eggstokkene skjer gjennom lymfekarene, spesielt rikelig i området rundt organporten, hvor den subovariære lymfepleksen utmerker seg. Deretter utledes lymfen langs eggstokklymfekarene til de paraaorta lymfeknutene.
Innervasjon av eggstokkene
Sympatisk - levert av postganglionære fibre fra cøliaki- (solar-), mesenterial- og hypogastriske plexus; parasympatisk - av de viscerale sakralnervene.
Strukturen til eggstokken
Overflaten på eggstokken er dekket av et enkeltlags germinalt epitel. Under dette ligger et tett proteinlag av bindevev (tunica albuginea). Bindevevet i eggstokken danner stroma (stroma ovarii), som er rik på elastiske fibre. Eggstokkens substans, parenkym, er delt inn i et ytre og et indre lag. Det indre laget, som ligger i midten av eggstokken, nærmere eggstokkens port, kalles medulla (medulla ovarii). I dette laget, i løst bindevev, finnes det en rekke blod- og lymfekar og nerver. Det ytre laget av eggstokken - cortex (cortex ovarii) - er tettere. Det inneholder mye bindevev, hvor de modne primære eggstokkfolliklene (folliculi ovarici primarii), sekundære (vesikulære) follikler (folliculi ovarici secundarii, s.vesiculosi) samt modne follikler, Graafske follikler (folliculi ovarici maturis), samt gule og atretiske legemer, befinner seg.
Hver follikkel inneholder et hunnlig reproduktivt egg, eller oocytt (ovocytus). Egget er opptil 150 µm i diameter, rundt, inneholder en kjerne, en stor mengde cytoplasma, som i tillegg til cellulære organeller inneholder protein-lipid-inneslutninger (eplomme) og glykogen, som er nødvendige for eggets næring. Egget bruker vanligvis opp næringsstoffene sine innen 12–24 timer etter eggløsning. Hvis befruktning ikke skjer, dør egget.
Menneskeeggcellene har to membraner som dekker dem. Inni ligger cytolemmaet, som er eggcellens cytoplasmatiske membran. Utenfor cytolemmaet ligger et lag med såkalte follikulære celler, som beskytter eggcellene og utfører en hormondannende funksjon – de skiller ut østrogener.
Livmorens, eggledernes og eggstokkenes fysiologiske posisjon tilveiebringes av opphengs-, fikserings- og støtteapparatene som forener bukhinnen, leddbåndene og bekkenvevet. Opphengsapparatet er representert av parvise formasjoner, det omfatter livmorens runde og brede leddbånd, eggstokkenes egenleddbånd og opphengsbånd. Livmorens brede leddbånd, eggstokkenes egenleddbånd og opphengsbånd holder livmoren i midtposisjon. De runde leddbåndene trekker livmorfundus fremover og gir den fysiologisk vippestilling.
Fikseringsapparatet (forankringsapparatet) sikrer livmorens plassering i midten av det lille bekkenet og gjør det praktisk talt umulig for den å forskyve seg til sidene, frem og tilbake. Men siden ligamentapparatet går ut fra livmoren i dens nedre del, er livmorens vipping i forskjellige retninger mulig. Fikseringsapparatet omfatter ligamenter som er plassert i det løse vevet i bekkenet og strekker seg fra den nedre delen av livmoren til bekkenets laterale, fremre og bakre vegger: sakromagiske, kardinale, uterovesikale og vesikopubiske ligamenter.
I tillegg til mesovariumet skilles følgende eggstokkleddbånd:
- Eggstokkens opphengsligament, tidligere betegnet som det infundibulopelviske ligamentet. Det er en fold i bukhinnen med blodårer (a. et v. ovarica) og lymfekar og nerver fra eggstokken som passerer gjennom den, strukket mellom bekkenets sidevegg, lumbalfascien (i området der arteria iliac communis deles i ytre og indre) og den øvre (tubale) enden av eggstokken;
- Eggstokkens egenligament går mellom bladene på det brede livmorligamentet, nærmere det bakre bladet, og forbinder den nedre enden av eggstokken med livmorens laterale kant. Eggstokkens egenligament er festet til livmoren mellom begynnelsen av egglederen og det runde ligamentet, bak og over sistnevnte. I ligamentets tykkelse går rr. ovarii, som er de endegrenene til livmorarterien;
- Appendikulært-ovarielt ligament Ligamentet strekker seg fra blindtarmenes mesenterium til høyre eggstokk eller det brede ligamentet i livmoren i form av en fold i bukhinnen. Ligamentet er inkonstant og observeres hos 1/2–1/3 av kvinnene.
Støtteapparatet er representert av musklene og fasciaen i bekkenbunnen, delt inn i nedre, midtre og øvre (indre) lag.
Det kraftigste er det øvre (indre) muskellaget, representert av den parvise muskelen som løfter anus. Det består av muskelbunter som sprer seg ut fra halebenet til bekkenbenene i tre retninger (pubococcygeus, iliococcygeus og ischiococcygeus). Dette muskellaget kalles også bekkenmembranen.
Det midterste muskellaget ligger mellom symfysen, kjønnsbenet og sittebenet. Det midterste muskellaget - urogenitaldiafragma - opptar den fremre halvdelen av bekkenåpningen, som urinrøret og skjeden passerer gjennom. I den fremre delen, mellom arkene, er det muskelbunter som danner urinrørets ytre lukkemuskel, i den bakre delen er det muskelbunter som går i tverrretningen - den dype tverrgående muskelen i perineum.
Det nedre (ytre) laget av bekkenbunnsmusklene består av overfladiske muskler, hvis form ligner tallet 8. Disse inkluderer den bulbocavernøse, ischiocavernøse, eksterne anallukkemuskelen og den overfladiske tverrgående perinealmuskelen.
Ontogenese av eggstokkene
Prosessen med follikkelvekst og atresi begynner i uke 20 av svangerskapet, og ved fødselen er det opptil 2 millioner oocytter igjen i jentas eggstokker. Ved menarch synker antallet til 300 tusen. I løpet av hele den reproduktive perioden når ikke mer enn 500 follikler modenhet og eggløsning. Den første veksten av follikler er ikke avhengig av FSH-stimulering, er begrenset, og atresi oppstår raskt. Det antas at i stedet for steroidhormoner er lokale autokrine/parakrine peptider den viktigste regulatoren for vekst og atresi av primære follikler. Det antas at prosessen med follikkelvekst og atresi ikke avbrytes av noen fysiologiske prosesser. Denne prosessen fortsetter i alle aldre, inkludert intrauterin periode og overgangsalder, og avbrytes av graviditet, eggløsning og anovulasjon. Mekanismen som utløser follikkelvekst og antallet deres i hver spesifikke syklus er fortsatt uklar.
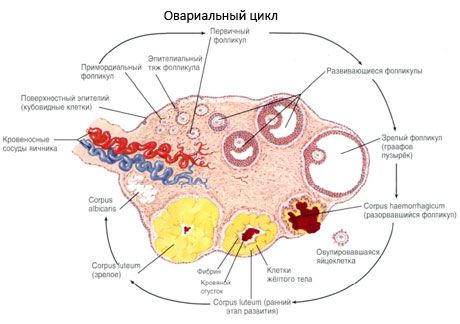
Under utviklingen gjennomgår follikkelen flere utviklingsstadier. Primordiale kimceller stammer fra endodermen i plommesekken, allantois, og migrerer til embryoets kjønnsdel i uke 5–6 av svangerskapet. Som et resultat av rask mitotisk deling, som fortsetter fra uke 6–8 til uke 16–20 av svangerskapet, dannes opptil 6–7 millioner oocytter i embryoets eggstokker, omgitt av et tynt lag med granulosaceller.
Preantral follikkel - oocytten er omgitt av en membran (Zona pellucida). Granulosacellene som omgir oocytten begynner å proliferere, veksten deres avhenger av gonadotropiner og korrelerer med nivået av østrogen. Granulosacellene er målet for FSH. I preantral follikkelstadiet er granulosacellene i stand til å syntetisere tre klasser steroider: induserer hovedsakelig aktiviteten til aromatase, hovedenzymet som omdanner androgener til østradiol. Det antas at østradiol er i stand til å øke antallet av sine egne reseptorer, og utøver en direkte mitogen effekt på granulosacellene uavhengig av FSH. Det regnes som en parakrin faktor som forsterker effekten av FSH, inkludert aktivering av aromatiseringsprosesser.
FSH-reseptorer dukker opp på membranene til granulosaceller så snart follikkelveksten begynner. En reduksjon eller økning i FSH fører til en endring i antallet reseptorer. Denne virkningen av FSH moduleres av vekstfaktorer. FSH virker gjennom G-proteinet, adenylatcyklasesystemet, selv om steroidogenesen i follikkelen hovedsakelig reguleres av FSH, er mange faktorer involvert i denne prosessen: ionekanaler, tyrosinkinasereseptorer, fosfolipasesystemet til andre budbringere.
Androgeners rolle i tidlig follikkelutvikling er kompleks. Granulosaceller har androgenreseptorer. Disse er ikke bare et substrat for FSH-indusert aromatisering til østrogener, men kan også forsterke aromatiseringen ved lave konsentrasjoner. Når androgennivåene øker, velger preantrale granulosaceller fortrinnsvis ikke aromatiseringsveien til østrogener, men den enklere androgenveien via 5a-reduktase for å konvertere til et androgen som ikke kan konverteres til østrogen, og dermed hemme aromataseaktiviteten. Denne prosessen hemmer også dannelsen av FSH- og LH-reseptorer, og stopper dermed follikkelutviklingen.
I aromatiseringsprosessen gjennomgår en follikkel med høye androgennivåer atresi. Follikkelens vekst og utvikling avhenger av dens evne til å omdanne androgener til østrogener.
I nærvær av FSH vil østrogener være den dominerende substansen i follikulærvæsken. I fravær av FSH - androgener. LH er normalt fraværende i follikulærvæsken frem til midten av syklusen. Så snart LH-nivået øker, reduseres den mitotiske aktiviteten til granulosacellene, degenerative forandringer oppstår, og androgennivået i follikkelen øker. Nivået av steroider i follikulærvæsken er høyere enn i plasma og gjenspeiler den funksjonelle aktiviteten til eggstokkcellene: granulosa- og thecaceller. Hvis det eneste målet for FSH er granulosaceller, har LH mange mål - thecaceller, stromale og luteinceller og granulosaceller. Både granulosa- og thecaceller har evnen til steroidogenese, men aromataseaktivitet dominerer i granulosaceller.
Som respons på LH produserer thecaceller androgener, som deretter omdannes av granulosaceller til østrogener gjennom FSH-indusert aromatisering.
Etter hvert som follikkelen vokser, begynner thecacellene å uttrykke gener for LH-reseptorer, P450 sec og 3beta-hydroksysteroiddehydrogenase. Insulinlignende vekstfaktor (IGF-1) synergistisk med LH øker genuttrykk, men stimulerer ikke steroidogenese.
Ovariell steroidogenese er alltid LH-avhengig. Etter hvert som follikkelen vokser, uttrykker thecacellene enzymet P450c17, som danner androgener fra kolesterol. Granulosaceller har ikke dette enzymet og er avhengige av thecaceller for å produsere østrogener fra androgener. I motsetning til steroidogenese er follikulogenese FSH-avhengig. Etter hvert som follikkelen vokser og østrogennivåene øker, aktiveres en tilbakekoblingsmekanisme - FSH-produksjonen hemmes, noe som igjen fører til en reduksjon i aromataseaktiviteten til follikkelen og til slutt til follikulær atresi gjennom apoptose (programmert celledød).
Tilbakekoblingsmekanismen til østrogener og FSH hemmer utviklingen av follikler som har begynt å vokse, men ikke den dominerende follikkelen. Den dominerende follikkelen inneholder flere FSH-reseptorer, som støtter proliferasjonen av granulosaceller og aromatiseringen av androgener til østrogener. I tillegg fungerer de parakrine og autokrine signalveiene som en viktig koordinator for utviklingen av antral follikkel.
Den autokrine/parakrine regulatoren består av peptider (inhibin, aktivin, follistatin), som syntetiseres av granulosaceller som respons på FSH og går inn i follikulærvæsken. Inhibin reduserer FSH-sekresjon; aktivin stimulerer frigjøringen av FSH fra hypofysen og forsterker virkningen av FSH i eggstokken; follistatin undertrykker FSH-aktivitet, muligens ved å binde aktivin. Etter eggløsning og utvikling av corpus luteum er inhibin under kontroll av LH.
Veksten og differensieringen av eggstokkceller påvirkes av insulinlignende vekstfaktorer (IGE). IGF-1 virker på granulosaceller og forårsaker en økning i syklisk adenosinmonofosfat (cAMP), progesteron, oksytocin, proteoglykan og inhibin.
IGF-1 virker på thecacellene og forårsaker økt androgenproduksjon. Thecacellene produserer igjen tumornekrosefaktor (TNF) og epidermal vekstfaktor (EGF), som også reguleres av FSH.
EGF stimulerer proliferasjonen av granulosaceller. IGF-2 er den viktigste vekstfaktoren i follikulærvæske, og IGF-1, TNF-α, TNF-3 og EGF finnes også i den.
Forstyrrelse av parakrin og/eller autokrin regulering av eggstokkfunksjonen ser ut til å spille en rolle i eggløsningsforstyrrelser og i utviklingen av polycystiske eggstokker.
Etter hvert som den antrale follikkelen vokser, øker østrogeninnholdet i follikulærvæsken. På toppen av økningen vises reseptorer for LH på granulosacellene, luteinisering av granulosacellene skjer, og progesteronproduksjonen øker. I den preovulatoriske perioden forårsaker en økning i østrogenproduksjonen dermed forekomsten av LH-reseptorer, som igjen forårsaker luteinisering av granulosacellene og progesteronproduksjon. En økning i progesteron reduserer østrogennivåene, noe som tilsynelatende forårsaker en andre topp av FSH midt i syklusen.
Eggløsning antas å inntreffe 10–12 timer etter LH-toppen og 24–36 timer etter østradiol-toppen. LH antas å stimulere redusert deling av oocytten, luteinisering av granulosaceller og syntese av progesteron og prostaglandin i follikkelen.
Progesteron forsterker aktiviteten til proteolytiske enzymer, som sammen med prostaglandin bidrar til ruptur av follikkelveggen. Den progesteroninduserte toppen av FSH lar oocytten forlate follikkelen ved å omdanne plasminogen til det proteolytiske enzymet plasmin, og gir et tilstrekkelig antall LH-reseptorer for normal utvikling av lutealfasen.
Innen 3 dager etter eggløsning øker granulosacellene i størrelse, og karakteristiske vakuoler fylt med pigmentet lutein dukker opp i dem. Theca-lutealceller differensierer fra theca og stroma og blir en del av corpus luteum. Kapillærer som trenger inn i corpus luteum utvikler seg svært raskt under påvirkning av angiogenesefaktorer, og med forbedret vaskularisering øker produksjonen av progesteron og østrogener. Aktiviteten til steroidogenese og levetiden til corpus luteum bestemmes av nivået av LH. Corpus luteum er ikke en homogen cellulær formasjon. I tillegg til 2 typer lutealceller inneholder det endotelceller, makrofager, fibroblaster, etc. Store lutealceller produserer peptider (relaxin, oksytocin) og er mer aktive i steroidogenese med større aromataseaktivitet og større syntese av progesteron enn små celler.
Toppnivået av progesteron inntreffer på den åttende dagen etter LH-toppen. Det bemerkes at progesteron og østradiol skilles ut episodisk i lutealfasen i korrelasjon med den pulserende produksjonen av LH. Med dannelsen av corpus luteum går kontrollen over inhibinproduksjonen fra FSH til LH. Inhibin øker med økningen i østradiol før LH-toppen og fortsetter å øke etter LH-toppen, selv om østrogennivåene synker. Selv om inhibin og østradiol skilles ut av granulosaceller, reguleres de av forskjellige veier. Nedgangen i inhibin på slutten av lutealfasen bidrar til økningen i FSH for neste syklus.
Corpus luteum avtar veldig raskt - på den 9.-11. dagen etter eggløsning.
Mekanismen for degenerasjon er uklar og er ikke relatert til østrogeners luteolytiske rolle eller til en reseptorrelatert mekanisme, slik det observeres i endometriet. Det finnes en annen forklaring på rollen til østrogener produsert av corpus luteum. Det er kjent at østrogener er nødvendige for syntesen av progesteronreseptorer i endometriet. Lutealfaseøstrogener er sannsynligvis nødvendige for progesteronrelaterte endringer i endometriet etter eggløsning. Utilstrekkelig utvikling av progesteronreseptorer, som en konsekvens av utilstrekkelige østrogennivåer, er muligens en ytterligere mekanisme for infertilitet og tidlig graviditetstap, en annen form for lutealfasedefekt. Det antas at corpus luteums levetid etableres ved eggløsningstidspunktet. Og det vil garantert gå tilbake hvis det ikke støttes av humant koriongonadotropin på grunn av graviditet. Dermed fører regresjon av corpus luteum til en reduksjon i nivåene av østradiol, progesteron og inhibin. En reduksjon i inhibin fjerner dens hemmende effekt på FSH; En reduksjon i østradiol og progesteron muliggjør en svært rask gjenoppretting av GnRH-sekresjon og fjerning av tilbakekoblingsmekanismen fra hypofysen. En reduksjon i inhibin og østradiol, sammen med en økning i GnRH, gir opphav til FSH over LH. En økning i FSH fører til follikkelvekst med påfølgende seleksjon av en dominant follikkel, og en ny syklus begynner hvis graviditet ikke inntreffer. Steroidhormoner spiller en ledende rolle i reproduksjonsbiologi og generell fysiologi. De bestemmer den menneskelige fenotypen, påvirker det kardiovaskulære systemet, beinmetabolismen, huden, generell velvære og spiller en nøkkelrolle i graviditet. Virkningen av steroidhormoner gjenspeiler de intracellulære og genetiske mekanismene som er nødvendige for å overføre et ekstracellulært signal til cellekjernen for å forårsake en fysiologisk respons.
Østrogener trenger diffust inn i cellemembranen og binder seg til reseptorer i cellekjernen. Reseptor-steroidkomplekset binder seg deretter til DNA. I målcellene fører disse interaksjonene til genuttrykk, proteinsyntese og spesifikk celle- og vevsfunksjon.


 [
[