Medisinsk ekspert av artikkelen
Nye publikasjoner
Behandling av alvorlig sepsis og septisk sjokk
Sist anmeldt: 04.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Effektiv behandling av sepsis er kun mulig med full kirurgisk sanering av infeksjonsstedet og tilstrekkelig antimikrobiell behandling. Utilstrekkelig initial antimikrobiell behandling er en risikofaktor for død hos pasienter med sepsis. Å opprettholde pasientens liv, forebygge og eliminere organdysfunksjoner er kun mulig med målrettet intensivbehandling.
Hovedmålet er å optimalisere O2- transporten under forhold med økt forbruk, noe som er typisk for alvorlig sepsis og septisk sjokk. Denne behandlingen implementeres gjennom hemodynamisk og respiratorisk støtte.
Hemodynamisk støtte
Infusjonsbehandling
Infusjonsbehandling er et av de første tiltakene for å opprettholde hemodynamikk og fremfor alt hjerteminuttvolum. Hovedoppgavene hos pasienter med sepsis er:
- gjenopprettelse av tilstrekkelig vevsperfusjon,
- korreksjon av homeostaseforstyrrelser,
- normalisering av cellulær metabolisme,
- reduksjon i konsentrasjonen av septiske kaskademediatorer og giftige metabolitter.
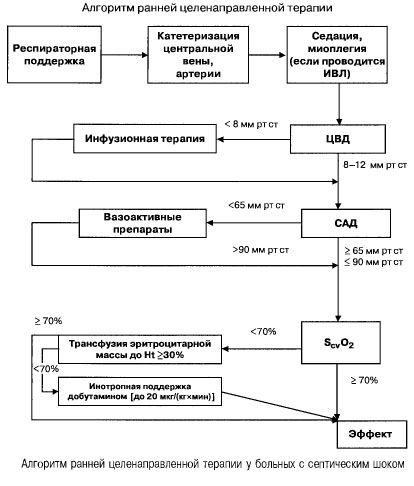
Ved sepsis med multippel organsvikt og septisk sjokk prøver de raskt (innen de første 6 timene) å oppnå følgende verdier av viktige indikatorer:
- hematokrit >30 %,
- diurese 0,5 ml/(kg/h),
- blodmetning i vena cava superior eller høyre atrium >70 %,
- gjennomsnittlig blodtrykk >65 mm Hg,
- CVP 8–12 mm Hg
Å opprettholde disse verdiene på det spesifiserte nivået forbedrer pasientens overlevelse (evidenskategori B). Hemodynamisk overvåking ved bruk av et Swan-Ganz-kateter og PICCO-teknologi (transpulmonal termodilusjon og pulsbølgeanalyse) utvider mulighetene for å overvåke og vurdere effektiviteten av hemodynamisk terapi, men det finnes ingen bevis for at de forbedrer overlevelsen.
Den optimale forbelastningsverdien velges individuelt, siden det er nødvendig å ta hensyn til graden av endotelskade og tilstanden til lymfedrenasje i lungene, ventriklenes diastoliske funksjon og endringer i intrathorakalt trykk. Volumet av infusjonsbehandling velges slik at PCWP ikke overstiger plasma-COP (forebygging av OL) og det er en økning i CO. I tillegg tas det hensyn til parameterne som karakteriserer lungenes gassutvekslingsfunksjon (paO2 og paO2 / FiO2 ) og endringer i det radiografiske bildet.
For infusjonsbehandling som en del av den målrettede behandlingen av sepsis og septisk sjokk, brukes krystalloide og kolloidale løsninger med tilnærmet identiske resultater.
Alle infusjonsmedier har både fordeler og ulemper. I dag, gitt resultatene av eksperimentelle og kliniske studier, er det ingen grunn til å foretrekke noen bestemt type.
- For eksempel, for tilstrekkelig korrigering av venøs retur og preload-nivå, er det nødvendig å administrere et volum av krystalloider som er 2-4 ganger større enn kolloider, noe som er assosiert med særegenheter ved løsningsfordeling i kroppen. I tillegg er krystalloidinfusjon assosiert med en større risiko for vevsødem, og deres hemodynamiske effekt er kortere enn kolloiders. Samtidig er krystalloider billigere, påvirker ikke koagulasjonspotensialet og fremkaller ikke anafylaktoide reaksjoner. Basert på det ovennevnte bestemmes den kvalitative sammensetningen av infusjonsprogrammet avhengig av pasientens egenskaper, tatt i betraktning graden av hypovolemi, fasen av DIC-syndrom, tilstedeværelsen av perifert ødem og konsentrasjonen av albumin i blodserumet, alvorlighetsgraden av akutt lungeskade.
- Plasmasubstitutter (dekstraner, gelatinpreparater, hydroksyetylstivelse) er indisert ved alvorlig BCC-mangel. Hydroksyetylstivelser med en substitusjonsgrad på 200/0,5, 130/0,4 og 130/0,42 har en potensiell fordel fremfor dekstraner på grunn av lavere risiko for membranrømning og fravær av klinisk signifikant effekt på hemostasen.
- Innføring av albumin under kritiske tilstander kan øke risikoen for død. Økningen i COP under infusjon er forbigående, og deretter, under forhold med økt permeabilitet i kapillærsjiktet ("kapillærlekkasje"-syndromet), oppstår ytterligere ekstravasasjon av albumin. Det er mulig at albumintransfusjon bare vil være nyttig hvis konsentrasjonen i serum er mindre enn 20 g/l og det ikke er tegn på "lekkasje" inn i interstitiet.
- Bruk av kryoplasma er indisert for forbrukskoagulopati og redusert koagulasjonspotensial i blodet.
- Den utbredte bruken av donorblodlegemer bør begrenses på grunn av den høye risikoen for å utvikle ulike komplikasjoner (APL, anafylaktiske reaksjoner, etc.). Ifølge de fleste eksperter er minimum hemoglobinkonsentrasjon hos pasienter med alvorlig sepsis 90–100 g/l.
Korrigering av hypotensjon
Lavt perfusjonstrykk krever umiddelbar aktivering av legemidler som øker vaskulær tonus og/eller hjertets inotropiske funksjon. Dopamin eller noradrenalin er førstelinjemedisiner for korrigering av hypotensjon hos pasienter med septisk sjokk.
Dopamin (dopmin) i en dose på <10 mcg/(kg x min) øker blodtrykket, primært ved å øke CO, og har minimal effekt på systemisk vaskulær motstand. Ved høye doser dominerer den α-adrenerge effekten, noe som fører til arteriell vasokonstriksjon, og ved en dose på <5 mcg/(kg x min) stimulerer dopamin dopaminerge reseptorer i nyre-, mesenteriske og koronarkar, noe som fører til vasodilatasjon, økt glomerulær filtrasjon og Na+-utskillelse.
Noradrenalin øker gjennomsnittlig arterielt trykk og øker glomerulær filtrasjon. Optimalisering av systemisk hemodynamikk under påvirkning fører til forbedring av nyrefunksjonen uten bruk av lave doser dopamin. Studier de siste årene har vist at isolert bruk, sammenlignet med en kombinasjon med høye doser dopamin, fører til en statistisk signifikant reduksjon i dødelighet.
Adrenalin er et adrenergt legemiddel med de mest uttalte hemodynamiske bivirkningene. Det har en doseavhengig effekt på hjertefrekvens, gjennomsnittlig arterielt trykk, hjerteminuttvolum, venstre ventrikkelfunksjon og O2-tilførsel og -forbruk . Imidlertid forekommer takyarytmier, forverring av organblodstrømmen og hyperlaktatemi samtidig. Derfor er bruk av adrenalin begrenset til tilfeller av fullstendig refraktæritet mot andre katekolaminer.
Dobutamin er det foretrukne legemidlet for å øke CO- og O2-tilførsel og -forbruk ved normal eller forhøyet preload. På grunn av sin dominerende virkning på beta1-adrenerge reseptorer, er det mer effektivt enn dopamin til å øke disse parametrene.
Eksperimentelle studier har vist at katekolaminer, i tillegg til å støtte blodsirkulasjonen, kan regulere forløpet av systemisk betennelse ved å påvirke syntesen av viktige mediatorer med en fjern effekt. Under påvirkning av adrenalin, dopamin, noradrenalin og dobutamin reduserer aktiverte makrofager syntesen og utskillelsen av TNF-α.
Valget av adrenerge midler utføres i henhold til følgende algoritme:
- hjerteindeks 3,5–4 l/(min x m² ), SvO² > 70 % – dopamin eller noradrenalin,
- hjerteindeks <3,5 l/(min x m² ), SvO2 <70 % - dobutamin (hvis systolisk blodtrykk <70 mm Hg - sammen med noradrenalin eller dopamin).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Respirasjonsstøtte
Lungene er blant de første målorganene som er involvert i den patologiske prosessen ved sepsis. Akutt respirasjonssvikt er en av de viktigste komponentene i multiorgandysfunksjon. Dens kliniske og laboratoriemessige manifestasjoner ved sepsis tilsvarer ALI, og med progresjonen av den patologiske prosessen - ARDS. Indikasjoner for mekanisk ventilasjon ved alvorlig sepsis bestemmes avhengig av alvorlighetsgraden av parenkymatøs respirasjonssvikt (ARF eller ARDS). Kriteriet er respirasjonsindeksen:
- <200 - trakeal intubasjon og respiratorstøtte er indisert,
- >200 - avlesningene bestemmes individuelt.
Hvis pasienten er bevisst under spontan pusting med oksygenstøtte, det ikke er høy belastning på pustearbeidet og uttalt takykardi (HR <120 per minutt), normalverdien av venøs retur SO2 > 90%, er det mulig å avstå fra å overføre til kunstig ventilasjon. Det er imidlertid nødvendig å overvåke pasientens tilstand nøye. Den optimale verdien av SO2 er omtrent 90%. Den kan opprettholdes ved ulike metoder for gasstilførsel (ansiktsmasker, nesekatetre) i ikke-giftige konsentrasjoner (FiO2 < 0,6). Ikke-invasiv kunstig ventilasjon er kontraindisert ved sepsis (evidenskategori B).
Høyvolums mekanisk ventilasjon (MVV) (VO = 12 ml/kg) bør unngås, da utskillelsen av cytokiner fra lungene i slike tilfeller øker, noe som fører til forverring av MOF. Det er nødvendig å følge konseptet med sikker mekanisk ventilasjon, noe som er mulig hvis følgende betingelser er oppfylt (evidenskategori A):
- DO <10 ml/kg,
- ikke-invertert forhold mellom innånding og utånding,
- maksimalt luftveistrykk <35 cm H2O,
- FiO2 <0,6 .
Valget av respirasjonssyklusparametere utføres inntil tilstrekkelig mekanisk ventilasjon er oppnådd. Kriteriene er paO2 > 60 mm Hg, SpO2 > 88–93 %, pvO2 35–45 mm Hg, SvO2 > 55 %.
En av de effektive metodene for å optimalisere gassutveksling er å utføre kunstig ventilasjon i mageleie (Prone Positioning) (evidenskategori B). Denne stillingen er effektiv hos pasienter i den mest alvorlige tilstanden, selv om effekten på å redusere dødeligheten på lang sikt er statistisk ubetydelig.
Ernæringsstøtte
Å gi kunstig ernæringsstøtte er et viktig element i behandlingen, et av de obligatoriske tiltakene, siden utviklingen av syndromet med multippel organsvikt ved sepsis vanligvis ledsages av manifestasjoner av hypermetabolisme. I en slik situasjon dekkes energibehovet ved ødeleggelse av ens egne cellulære strukturer (autokannibalisme), noe som forverrer organdysfunksjon og øker endotoksikosen.
Ernæringsstøtte anses som en metode for å forebygge alvorlig utmattelse (protein-energimangel) mot en markant økning i kata- og metabolisme. Inkludering av enteral ernæring i komplekset med intensiv terapi forhindrer bevegelse av tarmmikrofloraen, dysbakteriose, øker den funksjonelle aktiviteten til enterocytter og de beskyttende egenskapene til tarmslimhinnen. Disse faktorene reduserer graden av endotoksikose og risikoen for sekundære infeksjonskomplikasjoner.
Beregning av ernæringsstøtte:
- energiverdi - 25–35 kcal/(kg kroppsvekt x dag),
- mengde protein - 1,3–2,0 g/(kg kroppsvekt x dag),
- mengde karbohydrater (glukose) - mindre enn 6 g/kg/dag,
- mengde fett - 0,5–1 g/kg/dag,
- glutamindipeptider 0,3–0,4 g/kg/dag,
- vitaminer - standard daglig sett + vitamin K (10 mg/dag) + vitamin B1 og B6 ( 100 mg/dag) + vitamin A, C, E
- mikroelementer - standard daglig dose + Zn (15–20 mg/dag + 10 mg/dag ved løs avføring),
- elektrolytter - Na+, K+, Ca2+ i henhold til balanseberegninger og konsentrasjon i plasma.
Tidlig oppstart av ernæringsstøtte (24–36 timer) er mer effektivt enn på 3.–4. dag med intensiv behandling (evidenskategori B), spesielt ved enteral sondeernæring.
Ved alvorlig sepsis er det ingen fordeler med enteral eller parenteral ernæring; varigheten av organdysfunksjon og varigheten av respiratorisk og inotropisk støtte er den samme, og dødeligheten er den samme. Gitt det ovennevnte er tidlig enteral ernæring et billigere alternativ til parenteral ernæring. Bruk av blandinger beriket med kostfiber (prebiotika) for sondeernæring reduserer forekomsten av diaré betydelig hos pasienter med alvorlig sepsis.
For effektiv proteinsyntese i kroppen er det viktig å opprettholde metabolsk forhold "totalt nitrogen, g - ikke-proteinkalorier, kcal" = 1-(110-130). Maksimal dose karbohydrater er 6 g / (kg kroppsvekt per dag), siden innføring av store doser truer hyperglykemi og aktivering av katabolisme i skjelettmuskulatur. Fettemulsjoner anbefales å administreres døgnet rundt.
Kontraindikasjoner for ernæringsstøtte:
- dekompensert metabolsk acidose,
- individuell intoleranse mot ernæringsstøttende medier,
- alvorlig uoppdaget hypovolemi,
- refraktært sjokk - dopamindose >15 mcg/(kg x min) og systolisk blodtrykk <90 mm Hg,
- alvorlig, vanskelig å behandle arteriell hypoksemi.
Glykemisk kontroll
Et viktig aspekt ved kompleks behandling av alvorlig sepsis er konstant overvåking av glukosekonsentrasjonen i blodplasma og insulinbehandling. Høy glykemi og behovet for korrigering av denne er faktorer som bidrar til et ugunstig utfall ved sepsis. Gitt de ovennevnte omstendighetene opprettholdes normoglykemi (4,5–6,1 mmol/l) hos pasienter, og når glukosekonsentrasjonen øker over akseptable verdier, utføres insulininfusjon (0,5–1 U/t). Avhengig av den kliniske situasjonen overvåkes glukosekonsentrasjonen hver 1.–4. time. Ved implementering av denne algoritmen ble det observert en statistisk signifikant økning i pasientoverlevelse.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoider
Resultatene fra moderne studier angående effektiviteten av glukokortikoidbruk hos pasienter med septisk sjokk er oppsummert i følgende utsagn:
- Det er upassende å bruke hormoner i høye doser [metylprednisolon 30–120 mg/(kg x dag) én gang eller i 9 dager, deksametason 2 mg/(kg x dag) i 2 dager, betametason 1 mg/(kg x dag) i 3 dager] – økt risiko for sykehusinfeksjoner, ingen effekt på overlevelse,
- Bruk av hydrokortison i en dose på 240–300 mg per dag i 5–7 dager akselererer stabiliseringen av hemodynamiske parametere, tillater seponering av vaskulær støtte og forbedrer overlevelse hos pasienter med samtidig relativ binyreinsuffisiens (evidenskategori B).
Det er nødvendig å forlate den kaotiske empiriske forskrivningen av prednisolon og deksametason – det er ikke grunnlag for å ekstrapolere ny informasjon til dem. I mangel av laboratoriebevis for relativ binyreinsuffisiens administreres hydrokortison i en dose på 300 mg per dag (i 3–6 injeksjoner).
- i refraktært sjokk,
- hvis høye doser vasopressorer er nødvendige for å opprettholde effektiv hemodynamikk.
Det er mulig at ved systemisk betennelse i septisk sjokk er effekten av hydrokortison assosiert med aktivering av nukleær faktor kB-hemmeren (NF-kB-a) og korreksjon av relativ binyreinsuffisiens. Hemming av aktiviteten til transkripsjonsnukleær faktor (NF-kB) fører igjen til en reduksjon i dannelsen av induserbar NO-syntetase (NO er den kraftigste endogene vasodilatatoren), proinflammatoriske cytokiner, COX og adhesjonsmolekyler.
Aktivert protein C
En av de karakteristiske manifestasjonene av sepsis er en forstyrrelse av systemisk koagulasjon (aktivering av koagulasjonskaskaden og hemming av fibrinolyse), som til slutt fører til hypoperfusjon og organdysfunksjon. Effekten av aktivert protein C på det inflammatoriske systemet realiseres på flere måter:
- reduksjon av selektinbinding til leukocytter, som beskytter endotelet mot skade, noe som spiller en nøkkelrolle i utviklingen av systemisk betennelse,
- redusert frigjøring av cytokiner fra monocytter,
- blokkering av frigjøring av TNF-α fra leukocytter,
- hemming av trombinproduksjon (det forsterker den inflammatoriske responsen).
Antikoagulerende, profibrinolytisk og antiinflammatorisk virkning
- aktivert protein C skyldes
- nedbrytning av faktorene Va og VIIIa - undertrykkelse av trombedannelse,
- undertrykkelse av plasminogenaktivatorhemmer - aktivering av fibrinolyse,
- direkte antiinflammatorisk effekt på endotelceller og nøytrofiler,
- beskyttelse av endotelet mot apoptose
Administrasjon av aktivert protein C [drotrecogin alfa (aktivert)] med 24 mcg/(kg time) i 96 timer reduserer risikoen for død med 19,4 %. Indikasjoner for administrering: sepsis med akutt MOF og høy risiko for død (APACHE II > 25 poeng, dysfunksjon i 2 eller flere organer, evidenskategori B).
Aktivert protein C reduserer ikke dødeligheten hos barn, pasienter med enkeltorgansvikt, APACHE II < 25 poeng, hos pasienter med ikke-kirurgisk sepsis.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Immunglobuliner
Det tilrådelige med intravenøs administrering av immunglobuliner (IgG og IgG+IgM) er assosiert med deres evne til å begrense den overdrevne virkningen av proinflammatoriske cytokiner, øke clearance av endotoksiner og stafylokokk-superantigen, eliminere anergi og forsterke effekten av ß-laktamantibiotika. Bruken av dem i behandlingen av alvorlig sepsis og septisk sjokk er den eneste metoden for immunkorreksjon som øker overlevelse. Den beste effekten ble registrert ved bruk av en kombinasjon av IgG og IgM [RR=0,48 (0,35–0,75), evidenskategori A]. Standard doseringsregime er 3–5 ml/(kg x dag) i 3 dager på rad. Ved bruk av immunglobuliner ble de mest optimale resultatene oppnådd i den tidlige fasen av sjokk ("varmt sjokk") og hos pasienter med alvorlig sepsis (APACHE II-score på 20–25 poeng).
Forebygging av dyp venetrombose
Forebygging av DVT i nedre ekstremiteter påvirker behandlingsresultatene betydelig hos pasienter med sepsis (evidenskategori A). Både ufraksjonert og LMWH brukes til dette formålet. De viktigste fordelene med lavmolekylære hepariner er lavere forekomst av hemorragiske komplikasjoner, svakere effekt på blodplatefunksjonen og langvarig effekt (kan administreres én gang daglig).
Forebygging av dannelse av stresssår i mage-tarmkanalen
Denne retningen spiller en betydelig rolle i et gunstig utfall i behandlingen av pasienter med alvorlig sepsis og septisk sjokk, siden dødeligheten for blødning fra stresssår i mage-tarmkanalen er 64–87 %. Uten forebyggende tiltak forekommer stresssår hos 52,8 % av kritisk syke pasienter. Bruk av protonpumpehemmere og histamin H2-reseptorblokkere reduserer imidlertid risikoen med mer enn 2 ganger (den første gruppen medikamenter er mer effektiv enn den andre). Hovedretningen for forebygging og behandling er å opprettholde pH innenfor 3,5–6,0. Det bør understrekes at i tillegg til de ovennevnte legemidlene spiller enteral ernæring en viktig rolle i å forhindre dannelse av stresssår.
Ekstrakorporal blodrensing
Ulike biologisk aktive stoffer og metabolske produkter involvert i utviklingen av generalisert betennelse er mål for avgiftningsmetoder, noe som er spesielt viktig i fravær av naturlig hepatorenal clearance ved tilstander med multippel organsvikt. Metoder for nyreerstatningsterapi anses som lovende, da de ikke bare kan påvirke uremiske lidelser hos pasienter med nyresvikt, men også ha en positiv effekt på andre endringer i homeostase og organdysfunksjoner som oppstår ved sepsis, sjokk og multippel organsvikt.
Til dags dato finnes det ingen data som bekrefter behovet for å bruke ekstrakorporale blodrensingsmetoder som en av hovedretningene for patogenetisk behandling av sepsis og septisk sjokk. Bruken av dem er berettiget ved multippel organsvikt med nyredominans.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialyse
Kjernen i metoden er diffusjon av stoffer med lav molekylvekt (opptil 5x10³ Da ) gjennom en semipermeabel membran og fjerning av overflødig væske fra kroppen langs en trykkgradient. Hemodialyse er mye brukt til å behandle pasienter med både kronisk og akutt nyresvikt. Diffusjonshastigheten til stoffer avhenger eksponentielt av deres molekylvekt. For eksempel er fjerningen av oligopeptider langsommere enn syntesen av dem.
Hemofiltrering
Hemofiltrering er en effektiv metode for å fjerne stoffer med en molekylvekt på 5x10³ - 5x10⁴ Da, og den eneste måten å fjerne en stor gruppe biologisk aktive stoffer og metabolitter fra kroppen. Metoden er basert på konveksjonsmetoden for masseoverføring. I tillegg til tilstrekkelig korreksjon av azotemi, fjerner hemofiltrering effektivt anafylatoksinene C3a, C5a, proinflammatoriske cytokiner (TNF-α, IL-1b, 6 og 8), ß2-mikroglobulin, myoglobin, paratyreoideahormon, lysozym (molekylvekt - 6000 Da), α-amylase (molekylvekt - 36 000-51 000 Da), kreatinfosfokinase, alkalisk fosfatase, transaminaser og andre stoffer. Hemofiltrering fjerner aminosyrer og plasmaproteiner (inkludert immunglobuliner og sirkulerende immunkomplekser).
Hemodiafiltrering
Hemodiafiltrering er den kraftigste metoden for blodrensing, og kombinerer diffusjon og konveksjon (dvs. GD og GF). Et ytterligere bidrag til avgiftningsprosessen kommer av sorpsjon av patologiske stoffer på filtermembranen.
Plasmaferese
Plasmaferese (plasmautveksling, plasmafiltrering) anses også som en mulig metode for å korrigere generalisert betennelse hos pasienter med sepsis og septisk sjokk. Den optimale metoden anses å være bruk av plasmautveksling i kontinuerlig modus med fjerning av 3-5 volumer plasma og samtidig erstatning med ferskfrosne, albumin-, kolloidale og krystalloide løsninger. Med en siktekoeffisient på 1 sikrer plasmafiltrering god fjerning av C-reaktivt protein, haptoglobin, komplementfragment C3, 1-antitrypsin, IL-6, tromboksan-B2, granulocyttstimulerende faktor, TNF. Bruk av sorbenter for å rense pasientens plasma reduserer risikoen for infeksjon og reduserer kostnadene for prosedyren, siden det ikke er behov for å bruke fremmede proteiner.
Bruk av langvarig infusjon av natriumselenitt (selenase) 1000 mcg/dag ved alvorlig sepsis fører til en reduksjon i dødelighet.
Selen er et essensielt mikroelement, hvis betydning er knyttet til dets nøkkelrolle i cellenes antioksidantsystemer. Selennivået i blodet holdes innenfor 1,9–3,17 μM/l. Behovet for selen er 50–200 μg per dag, og det avhenger av tilgjengeligheten av andre antioksidanter og mikroelementer.
Selen er en kraftig antioksidant, en komponent av glutationperoksidase, fosfolinglutationperoksidase, andre oksidoreduktaser og noen transferaser. Glutationperoksidase er den viktigste koblingen i det endogene antioksidantsystemet.
Selens effektivitet under kritiske forhold har blitt studert de siste årene. Disse studiene har vist at selenets viktigste virkningsmekanismer er:
- undertrykkelse av NF-kB hyperaktivering;
- redusert komplementaktivering;
- dens virkning som et immunmodulerende, antioksidant og antiinflammatorisk middel
- opprettholde peroksidutnyttelse;
- undertrykkelse av endoteladhesjon (redusert uttrykk av ICAM-1, VCAM-2,
- E - selektin, P - selektin);
- beskyttelse av endotelet mot oksyreadikaler (ved bruk av selenoprotein P, som forhindrer dannelsen av peroksynitritt fra O2 og NO).
For å oppsummere det ovennevnte, kan vi definere spesifikke oppgaver innen intensivbehandling ved alvorlig sepsis:
- Hemodynamisk støtte: CVP 8–12 mm Hg, gjennomsnittlig blodtrykk >65 mm Hg, diurese 0,5 ml/(kg t), hematokrit >30 %, blandet venøs blodmetning >70 %.
- Topptrykk i luftveiene ved respirasjonsstøtte <35 cm H2O, inspiratorisk oksygenfraksjon <60 %, tidevolum <10 ml/kg, ikke-invertert inspiratorisk/ekspiratorisk forhold.
- Glukokortikoider – «lave doser» (hydrokortison 240–300 mg per dag).
- Aktivert protein C 24 mcg/(kg t) i 4 dager ved alvorlig sepsis (APACHE II >25).
- Immunkorrigerende erstatningsterapi med pentaglobin.
- Forebygging av dyp venetrombose i nedre ekstremiteter.
- Forebygging av dannelse av stresssår i mage-tarmkanalen: bruk av protonpumpehemmere og H2-histaminreseptorblokkere.
- Substitusjonsterapi for akutt nyresvikt.
- Næringsinnhold: energiinnhold i mat 25–30 kcal/kg kroppsvekt x dag), protein 1,3–2,0 g/(kg kroppsvekt x dag), glutamindipeptider 0,3–0,4 g/(kg x dag), glukose – 30–70 % av ikke-proteinkalorier, forutsatt at glykemien opprettholdes <6,1 mmol/l, fett – 15–50 % av ikke-proteinkalorier.

