Medisinsk ekspert av artikkelen
Nye publikasjoner
Eksperimentelle modeller for artrose
Sist anmeldt: 07.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
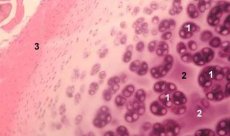
Brusk er et høyspesialisert vev som kun inneholder én type celler (kondrocytter) og er kjennetegnet av fravær av blod og lymfekar. Brusk næres hovedsakelig ved absorpsjon fra synovialvæsken. Kondrocytters metabolisme reguleres av en rekke løselige faktorer som produseres lokalt av kondrocytter og omkringliggende vev. Kondrocytters funksjon avhenger også av sammensetningen av det ekstracellulære miljøet (oksygentrykk, ionkonsentrasjon, pH, etc.), sammensetningen av ECM, interaksjonen mellom celler og matrisen, og fysiske signaler. Hovedmålet med eksperimentell modellering er å lage kulturer i det ekstracellulære miljøet uten å endre fenotypen til modne celler. Det andre målet er å lage kulturer for å studere den for tidlige, forsinkede, kortsiktige eller langvarige responsen til kondrocytter på kjemiske og/eller fysiske signaler. In vitro-studier gir også en mulighet til å studere kondrocytters oppførsel ved slitasjegikt. Det tredje målet er å utvikle samkultursystemer som tillater studier av interaksjonene mellom ulike vev i leddet. Den fjerde oppgaven er forberedelse av bruskimplantater for påfølgende transplantasjon. Og til slutt er den femte oppgaven studiet av vekstfaktorer, cytokiner eller terapeutiske midler som er i stand til å stimulere reparasjon og/eller hemme bruskresorpsjon.
I løpet av de siste tiårene har det blitt laget ulike modeller av leddbruskcellekulturer, inkludert monolagskulturer, suspenderte kulturer, kondronkulturer, eksplantater, kokulturer og udødelige cellekulturer. Hver kultur har sine egne fordeler og ulemper, og hver er egnet for å studere ett spesifikt aspekt ved kondrocyttmetabolisme. Dermed er bruskeksplantater en utmerket modell for å studere omsetningen av matrikselementer, noe som krever ekte celleoverflatereseptorer og normale celle-matriks- og matriks-celle-interaksjoner. Samtidig anbefales det å studere matriksavsetninger eller mekanismer som regulerer kondrocyttmetabolisme på en kultur av isolerte celler. En lavdensitets monolagskultur er nødvendig for å studere prosessen med celledifferensiering. Kulturer suspendert i en naturlig eller syntetisk matriks er en modell for å analysere den adaptive responsen til kondrocytter på mekanisk stress.
Kondrocyttkulturer
Flere viktige punkter bør tas i betraktning når man velger bruskvev for in vitro-studier. Matrikssammensetningen og den metabolske aktiviteten til kondrocytter varierer mellom ledd, og sistnevnte avhenger også av dybden av kondrocyttenes plassering i vevet. Disse dataene ble innhentet i flere eksperimenter der isolerte kondrocyttsubpopulasjoner fra brusksoner med ulik dybde ble studert. En rekke morfologiske og biokjemiske forskjeller ble funnet mellom dyrkede kondrocytter lokalisert i de overfladiske og dype lagene av leddbrusk. Overfladiske celler syntetiserer en sparsom, proteoglykanfattig fibrillær matriks, mens dypereliggende celler produserer en matriks rik på fibriller og proteoglykaner. Dessuten produserer overfladiske celler relativt flere små ikke-aggregerte proteoglykaner og hyaluronsyre og relativt mindre aggrekan og keratansulfat enn dypereliggende kondrocytter. Et annet viktig særtrekk ved metabolismen til kondrocytter isolert fra brusksoner med ulik dybde er responsen på en eksogen stimulus. Ifølge M. Aydelotte et al. var bovine kondrocytter fra den overfladiske sonen av brusk mer følsomme for IL-1 enn celler fra den dype sonen.
Celleoppførsel avhenger også av vevets plassering. Kondrocytter fra ribbein- og ørebrusk fra samme dyr reagerer ulikt på vekstfaktorer som fibroblastvekstfaktor (FGF) og TGF-beta. FGF økte innlemmelsen av tymidin, prolin og leucin i dyrkede ribbein, men ikke i ørekondrocytter. TGF-beta økte innlemmelsen av tymidin i ribbein- og ørebruskkondrocytter, men hadde ingen effekt på innlemmelsen av tymidin og prolin i ørekondrocytter. Bruskceller fra områder med høy belastning skiller seg fra de fra områder med lav belastning på brusken. Dermed syntetiserer kondrocytter fra kneleddbrusk fra moden sau fra den sentrale regionen av leddflaten på tibia som ikke er dekket av menisken, som bærer den største belastningen in vivo, mindre aggrecan, men mer decorin enn celler fra sonene som er dekket av menisken. Forfatterne understreker også viktigheten av å bruke brusk fra identiske leddsoner når man studerer den syntetiske funksjonen til ledd.
Metabolismen til kondrocytter og deres respons på regulatoriske faktorer avhenger også betydelig av donorens alder, deres skjelettutvikling og tilstanden til leddene som cellene er tatt fra. Hos humane kondrocytter observeres en betydelig reduksjon i den proliferative responsen med alderen. Den største reduksjonen observeres hos donorer i alderen 40–50 år og over 60 år. Dessuten avtar alvorlighetsgraden av den proliferative responsen på vekstfaktorer (f.eks. FGF og TGF-beta) med aldring. I tillegg til kvantitative endringer i kondrocyttproliferasjon, er det også kvalitative endringer. Celler fra unge donorer (10–20 år) responderer bedre på blodplateavledet vekstfaktor (PDGF) enn på TGF-beta, mens det motsatte observeres i celler fra voksne donorer. Flere mekanismer brukes til å forklare aldersavhengige endringer i den syntetiske funksjonen til kondrocytter og deres respons på vekstfaktorer. Disse inkluderer en reduksjon i antall og affinitet til overflatecellereseptorer, endringer i syntesen og bioaktiviteten til vekstfaktorer og cytokiner, og modifisering av postreseptorsignaler.
Patologiske tilstander i leddene endrer også morfologien og den metabolske aktiviteten til kondrocytter. J. Kouri et al. (1996) identifiserte derfor tre underpopulasjoner av kondrocytter i brusk ved slitasjegikt. Kondrocytter fra den overfladiske og øvre delen av midten av brusken danner klynger og syntetiserer en større mengde proteoglykaner og kollagen. TGF-beta og insulinlignende vekstfaktor (IGF) er i stand til å stimulere syntesen av proteoglykaner av kondrocytter og delvis nøytralisere effektene av IL-1 og TNF-α. Eksplanter av brusk påvirket av slitasjegikt og kondrocytter isolert fra brusken til en pasient med slitasjegikt er mer følsomme for stimulering av TGF-beta enn kondrocytter fra frisk brusk. Disse forskjellene er mest sannsynlig assosiert med fenotypiske endringer i kondrocytter i de øvre lagene av leddbrusk.
Isolering av individuelle kondrocytter oppnås ved sekvensiell behandling av ECM med proteolytiske enzymer. Etter at de er frigjort fra ECM, er de isolerte cellene ideelle for å studere de novo-syntesen av matrikskomponenter. Noen forfattere bruker kun klostridial kollagenase, mens andre preinkuberer brusken med trypsin, pronase, DNase og/eller hyaluronidase. Antallet isolerte celler avhenger av enzymene som brukes. Når man behandler med kollagenase alene, kan man dermed oppnå 1,4–10⁶ kondrocytter fra 1 g vev, mens man bruker pronase, hyaluronidase og kollagenase – 4,3–10⁶ . Når man behandler med kollagenase, forblir aggrecan, proteiner, IL-6 og IL-8 i cellekulturen i betydelig større mengder enn ved sekvensiell behandling med forskjellige enzymer. Det er flere forklaringer på disse forskjellene mellom de to cellekulturene:
- Cellereseptorer blir skadet eller hemmet av enzymer, mens TGF-beta hemmer DNA- og proteoglykansyntese i nylig isolerte kondrocytter (dag 1), mens DNA- og proteoglykansyntese i kondrocytter dyrket i et monolag (7 dager) stimuleres av TGF-beta. Imidlertid kreves det en tilstrekkelig periode for re-ekspresjon av disse membrankomponentene før eksperimentets start.
- Eksogene proteaser kan forstyrre den integrinmedierte celle-matriks-interaksjonen. Integrinfamilien fremmer bindingen av kondrocytter til ECM-molekyler (Shakibaei M. et al., 1997). Denne forstyrrelsen kan påvirke uttrykket av matriksgener.
- Rester av matrikskomponenter kan regulere den syntetiske funksjonen til kondrocytter. Integriner er i stand til å gjenkjenne produktene fra ECM-nedbrytning, og spiller dermed en viktig rolle i vevsreparasjon etter virkningen av proteolytiske enzymer. T. Larsson et al. (1989) rapporterte at tilsetning av intakte eller fragmenterte proteoglykaner til cellekultur stimulerer syntesen av proteiner og proteoglykaner. Imidlertid forårsaker et høyt nivå av hyaluronsyre en betydelig reduksjon i inkluderingen av sulfater i syntesen av proteoglykaner av kondrocytter i kyllingembryoer, modne kondrocytter i grise- og rottekondrosarkomceller. Dessuten er hyaluronsyre en hemmer av proteoglykanfrigjøring fra celler selv i nærvær av IL-1b, TNF-α, FGF, noe som indikerer motvirkning av den første biologiske aktiviteten til vekstfaktorer og cytokiner. Den nøyaktige mekanismen som ligger til grunn for virkningen av hyaluronsyre er fortsatt uklar; kondrocytter er kjent for å inneholde en reseptor for hyaluronsyre assosiert med aktinfilamenter i cytosolen. Binding av hyaluronsyre til reseptoren stimulerer proteinfosforylering. Dermed viser disse dataene modulering av kondrocytters metabolske funksjon av fragmenterte eller native molekyler av matriksproteiner gjennom aktivering av cellemembranreseptorer.
- Rask stimulering av matriksproteinsyntese av kondrocytter av enzymer kan være en konsekvens av endringer i kondrocyttform og/eller reorganisering av cytoskjelettet.
- Noen cytokiner (f.eks. IL-8) og vekstfaktorer (f.eks. IGF-1, TGF-β) er sekvestrert i ECM. Det mest kjente eksemplet er bindingen av TGF-β av dekorin, noe som resulterer i en redusert evne hos førstnevnte til å indusere cellevekst i kinesiske hamsterovarieceller. Funnet om at dekorininnholdet i brusk øker med alderen antyder en reduksjon i TGF-β biotilgjengelighet med aldring. Vekstfaktorer og cytokiner kan frigjøres fra matriksavfall under dyrking og deretter modulere kondrocyttfunksjonen.
Monolagskultur av kondrocytter
Den differensierte fenotypen til kondrocytter er primært karakterisert av syntesen av type II-kollagen og vevsspesifikke proteoglykaner, samt et lavt nivå av mitotisk aktivitet. Det finnes bevis for at kondrocytter mister sine sfæriske konturer og får en langstrakt, fibroblastlignende form ved langvarig celledyrking i et monolag, samt etter flere gjentatte cellepassasjer. Med slik fibroblastisk metaplasi endres også cellenes syntetiske funksjon, karakterisert ved en progressiv reduksjon i syntesen av kollagen type II, IX og XI og en økning i syntesen av kollagen type I, III og Y. Små ikke-aggregerte proteoglykaner syntetiseres på grunn av funksjonell aggrekan. Syntesen av katepsin B og L er ekstremt lav i differensierte celler, men øker i prosessen med tap av differensiering. Kollagenase-1 uttrykkes i differensierte kondrocytter; ved langvarig dyrking reduseres uttrykket, mens produksjonen av vevshemmere av metalloproteaser (TIMP) øker.
Differensierte kondrocytter reuttrykker kollagen av den differensierte fenotypen når de overføres fra monolag til suspendert kultur. Differensieringsprosessen er sannsynligvis relatert til celleformen. Denne egenskapen brukes jevnlig av forskere som studerer defekte transplantater med autologe kondrocytter. Et lite antall celler hentet fra biopsimateriale kan ekspanderes i monolagskultur og deretter introduseres på nytt i en tredimensjonal matrise før transplantasjon. Reuttrykk av en spesifikk fenotype av dedifferensierte kondrocytter overført til agarosekultur kan stimuleres av TGF-β, ossein-hydroksyapatittkompleks og askorbinsyre.
Som respons på vekstfaktorer og cytokiner modifiseres kondrocytter under differensieringsprosessen. Den cellulære responsen på cytokiner og vekstfaktorer er forskjellig mellom udifferensierte og differensierte kondrocytter. IL-1 stimulerer fibroblastproliferasjon, mens veksten av udifferensierte kondrocytter hemmes av IL-1. DNA-syntese stimuleres av IGF-1 i forlengede, men ikke flate kondrocytter. I differensierte kondrocytter er de stimulerende effektene av IL-1beta og TNF-α på prokollagenaseproduksjon mer uttalt enn i udifferensierte kondrocytter.
Dyrking av kondrocytter
Dyrking av kondrocytter i suspensjon i et flytende medium eller i en naturlig eller syntetisk tredimensjonal matrise stabiliserer kondrocyttfenotypen. Cellene beholder sin sfæriske form og syntetiserer vevsspesifikke proteiner. Suspendert kultur av kondrocytter anbefales vanligvis for å studere dannelsen av en ny pericellulær matrise. Kulturer av kondrocytter i syntetiske eller naturlige absorberende polymerer brukes til implantasjon av celler i bruskdefekter for å stimulere regenerering av leddbruskvev. Det syntetiske eller naturlige mediet for implanterte celler må oppfylle en rekke krav:
- implantater må ha en porøs struktur for celleadhesjon og vekst,
- Verken selve polymeren eller dens nedbrytningsprodukter skal forårsake betennelse eller toksiske reaksjoner når den implanteres in vivo,
- Transplantatbæreren må ha evnen til å binde seg til tilstøtende brusk eller subkondralt bein,
- den naturlige eller syntetiske matrisen må ha evnen til å absorbere, nedbrytningen må balanseres av vevsregenerering,
- For å legge til rette for bruskreparasjon, må den kjemiske strukturen og porearkitekturen i matriksen legge til rette for opprettholdelsen av den cellulære fenotypen og syntesen av vevsspesifikke proteiner av kondrocyttene som er plassert i den,
- Under in vivo-implantasjon er det nødvendig å studere de mekaniske egenskapene til den syntetiske eller naturlige matrisen.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Suspensjon av kondrocytter i flytende fase
Feste av celler til plastkar der kondrocytter dyrkes kan forhindres ved å belegge veggene deres med en løsning av metylcellulose, agarose, hydrogel (poly-2-hydroksyetylmetakrylat) eller en kollagen-agaroseblanding. Under disse forholdene danner kondrocytter klynger og syntetiserer hovedsakelig aggrekan og vevsspesifikke kollagener (II, IX, XI typer). To typer celler finnes vanligvis. Cellene som ligger i midten beholder en sfærisk form og er omgitt av et velutviklet ECM, noe som bekreftes av histokjemiske og ultrastrukturelle studier. I periferien har kondrocytter skiveformede konturer og er omgitt av et sparsomt ECM; lite er kjent om de funksjonelle egenskapene til slike celler.
Det er mulig å dyrke kondrocytter på mikrobærere som holdes i suspensjon; dekstrankuler (cytodex), kollagenbelagte dekstrankuler (cytodex III) og ikke-porøse mikrosfærer av type I kollagen (cellagen) brukes som mikrobærere. Under disse dyrkningsbetingelsene fester kondrocytter seg til overflaten av mikrobæreren, beholder sin sfæriske form og produserer et matrikslignende materiale. Dessuten fremmer bruk av cellagen kondrocyttproliferasjon og reekspresjon av den normale fenotypen. Derfor kan dyrking av kondrocytter på cellagenmikrosfærer brukes til å gjenopprette cellefenotypen før transplantasjon.
En annen metode for dyrking av kondrocytsuspensjoner i et flytende medium er dyrking i form av tette kuler bestående av celler (0,5-1 * 10 b ), oppnådd ved sentrifugering. Slike kondrocytter er i stand til å produsere en matrise som inneholder en stor mengde proteoglykaner, kollagen type II, men ikke kollagen type I, noe som bekreftes av histologiske, immunhistokjemiske og kvantitative metoder.
Suspensjon av kondrocytter i naturlig ECM
Kondrocytter kan dyrkes i suspensjon i en tredimensjonal matrise (myk agar, agarose, kollagengel eller -svamp, hyaluronsyre, fibrinlim, alginatkuler).
Kondrocytter dyrket i agarose beholder sin normale fenotype og syntetiserer type II-kollagen og vevsspesifikke aggrekanaggregater. Ved dyrking i agarose frigjøres proteoglykaner syntetisert av cellen i mediet i 50 dager. Til sammenligning er cellefasen i en monolagskultur overfylt med glykosaminoglykaner allerede i løpet av de første 5–6 dagene av dyrkingen; ved dyrking i mediet, etter økt syntese og frigjøring av glykosaminoglykaner i løpet av de første 8–10 dagene, skjer en tidsavhengig reduksjon. Likevel er kondrocytters oppførsel når de dyrkes i agarose forskjellig fra den in vivo. I agarose inneholder et stort antall syntetiserte aggrekanaggregater mindre molekyler og færre molekyler enn in vivo. TGF-β stimulerer proteoglykansyntesen i eksplantatet, men reduserer aggrekansyntesen i agarose.
Alginat er et lineært polysakkarid utvunnet fra brunt tang. I nærvær av toverdige kationer, som Ca2 + -ioner, blir denne polymeren en gel. Hver kondrocytt fanget i alginat er omgitt av en matrise av negativt ladede polysakkarider, hvis porer er sammenlignbare med de i hyalinbrusk. Matrisen som dannes av kondrocytter i alginatkuler består av to rom - et tynt lag med celleassosiert matrise som tilsvarer den pericellulære og territoriale matrisen i leddbrusk og en fjernere matrise som tilsvarer den interterritoriale i naturlig vev. På den 30. dagen av dyrkingen er det relative og absolutte volumet som opptas av cellene og hvert av de to rommene i en alginatkule nesten fullstendig identisk med volumet i naturlig brusk. I nesten 30 dager beholder kondrocytter sin sfæriske form og produserer aggrecan, hvis hydrodynamiske egenskaper ligner på de til aggrecanmolekyler i leddbruskmatrisen, samt kollagenmolekyler av typene II, IX og XI. Samtidig, i likhet med andre suspensjonskulturer, er det flate celler på overflaten av alginatkuler, som produserer en liten mengde kollagenmolekyler av type I, som frigjøres direkte i mediet og ikke innlemmes i ECM. Moderat proliferasjon av kondrocytter observeres i alginatkuler. Etter 8 måneders dyrking i alginatgel mister ikke modne kondrocytter metabolsk aktivitet og fortsetter å syntetisere vevsspesifikt kollagen type II og aggrecan.
H. Tanaka et al. (1984) undersøkte diffusjonsegenskapene til ulike naturlige molekyler i alginat og fant at molekyler større enn 70 kDa ikke diffunderte gjennom alginat. Dermed er cellekultur i alginat egnet for å studere reguleringen av matriksbiosyntese og ECM-organisering. Tilgjengeligheten av celler dyrket i alginat gjør det mulig å studere virkningen av peptidregulerende faktorer og farmakologiske midler på transkripsjons-, post-transkripsjons- og translasjonsnivå.
Kondrocytter dyrkes også i en matrise av kollagenfibre av type I og II. S. Nehrer et al. (1997) sammenlignet funksjonen til hundekondrocytter i porøse kollagen-proteoglykan-polymermatriser som inneholdt kollagener av forskjellige typer. De fant viktige forskjeller i morfologien til den biosyntetiske funksjonen til kondrocytter dyrket i kollagenmatriser som inneholdt kollagen av type I og II. Celler i en matrise av kollagen type II beholdt sin sfæriske form, mens de i kollagen type I hadde en fibroblastlignende morfologi. Dessuten produserte kondrocytter i en matrise av kollagen type II en større mengde glykosaminoglykaner. J. van Susante et al. (1995) sammenlignet egenskapene til kondrocytter dyrket i alginat og kollagen (type I) gel. Forfatterne fant en betydelig økning i antall celler i kollagengelen, men fra den 6. dagen av dyrking mistet cellene sin karakteristiske fenotype og ble til fibroblastlignende celler. I alginatgelen ble det observert en reduksjon i antall celler, men kondrocyttene beholdt sin normale fenotype. I kollagengelen var antallet proteoglykaner per celle betydelig høyere enn i alginat, men i gelen ble det observert en reduksjon i syntesen av matrikselementer, startende fra den 6. dagen av dyrkingen, mens syntesen i alginat fortsatte å øke.
Fast tredimensjonal fibrinmatrise er et naturlig stoff som støtter kondrocytter suspendert i den i en differensiert fenotype. Tredimensjonal fibrinmatrise kan også brukes som bærer ved kondrocyttransplantasjon. Fordelene med fibrin er fravær av cytotoksisitet, evnen til å fylle rom og adhesjonskapasitet. Histologiske og biokjemiske studier, autoradiografi og elektronmikroskopi har vist at kondrocytter i fibringel beholder sin morfologi, prolifererer og produserer matrise selv etter 2 ukers dyrking. G. Homminga et al. (1993) rapporterte imidlertid at fibrin-oppløsningen begynner etter 3 dagers dyrking, og kondrocytt-dedifferensieringen utvikler seg.
Suspensjon av kondrocytter i kunstig (syntetisk) ECM
Bruskimplantater for rekonstruktiv eller ortopedisk kirurgi kan oppnås ved å dyrke isolerte kondrocytter in vitro i en syntetisk biokompatibel matrise.
Kondrocytter dyrket i polyglykolsyre prolifererer og opprettholder normal morfologi og fenotype i 8 uker. Kondrocytt-polyglykolsyrekomplekset består av celler, glykosaminoglykaner, kollagener og har en ekstern kollagenkapsel. Slike implantater inneholder imidlertid to typer kollagenmolekyler - I og II. Implantater fra kondrocytter dedifferensiert av en serie passasjer har en større mengde glykosaminoglykaner og kollagener enn implantater fra primært udifferensierte kondrocytter.
L. Freed et al. (1993b) sammenlignet oppførselen til humane og bovine kondrocyttkulturer i fibrøs polyglykolsyre (FPGA) og porøs polymelkesyre (PPLA). Etter 6–8 uker med dyrking av bovine kondrocytter i FPGA eller PPLA observerte forfatterne celleproliferasjon og regenerering av bruskmatrisen. I FPGA hadde kondrocyttene en sfærisk form og var lokalisert i lakuner omgitt av en bruskmatrise. Etter 8 uker med in vitro-dyrking inneholdt det regenererte vevet opptil 50 % tørrstoff (4 % cellemasse, 15 % glykosaminoglykaner og 31 % kollagener). I PPLA hadde cellene en spindelformet form og en liten mengde glykosaminoglykaner og kollagen. I FPGA var celleveksten dobbelt så intens som i PPLA. In vivo produserte kondrocytter dyrket i VPGK og PPLC vev som var histologisk likt brusk, innen 1–6 måneder. Implantatene inneholdt glykosaminoglykaner, kollagener type I og II.
Bovine føtale kondrocytter ble dyrket i porøst hydrofobt og hydrofilt polyetylen med høy tetthet. Etter 7 dagers inkubasjon i begge substratene beholdt cellene en sfærisk form og inneholdt hovedsakelig type II-kollagen. Etter 21 dagers dyrking ble det funnet at den hydrofile matriksen inneholdt mer type II-kollagen enn den hydrofobe matriksen.
Bruskvev kan også utvinnes ved dyrking i et monolag på Millicell-CM-filtre. Forbelegging av filtrene med kollagen er nødvendig for feste av kondroitiner. Histologisk undersøkelse av kulturen viser akkumulering av kondrocytter i ECM som inneholder proteoglykaner og type II-kollagen. Type I-kollagen ble ikke påvist i en slik kultur. Kondrocytter i det oppnådde bruskvevet er sfæriske i formen, men på overflaten av vevet er de noe flate. Tykkelsen på det nydannede vevet økte med tiden og var avhengig av den initiale tettheten til cellemonolaget. Under optimale dyrkingsforhold nådde tykkelsen på bruskvevet 110 μm, og organiseringen av cellene og kollagenet i overfladiske og dype lag er lik den for leddbrusk. ECM inneholder omtrent 3 ganger mer kollagen og proteoglykaner. Etter 2 ukers dyrking ble det observert matriksakkumulering, slik at vevet kunne ekstraheres fra filteret og brukes til transplantasjon.
Sims et al. (1996) studerte dyrking av kondrocytter i polyetylenoksidgel, en innkapslet polymermatrise som tillater overføring av et stort antall celler ved injeksjon. Seks uker etter injeksjon i det subkutane vevet hos atymiske mus ble det dannet ny brusk, som morfologisk ble karakterisert av en hvit opalescens som ligner på hyalinbrusk. Histologiske og biokjemiske data indikerte tilstedeværelsen av aktivt prolifererende kondrocytter som produserer ECM.
Eksplantasjon
Eksplantasjon av bruskvev brukes til å studere prosessene for ana- og katabolisme i det, opprettholdelse av homeostase, resorpsjon og reparasjon. Kondrocytter i bruskeksplantater opprettholder en normal fenotype og ECM-sammensetning som ligner på de i leddbrusk in vivo. Etter 5 dager med dyrking i nærvær av serum oppnås et konstant nivå av syntese og naturlige nedbrytningsprosesser. Vevsresorpsjon kan akselereres i hovedkulturen og i kultur ved tilsetning av serum ved bruk av en rekke midler, som IL-IB, TNF-α, bakterielle lipopolysakkarider, retinsyrederivater eller aktive oksygenradikaler. For å studere bruskreparasjon induseres skaden av løselige inflammatoriske mediatorer (H₂O₂ ,IL -1, TNF- α ) eller fysisk ruptur av matriksen.
Den organotypiske dyrkningsmetoden er en modell for in vitro-studier av effektene av isolerte eksterne faktorer på kondrocytter og den omkringliggende matriksen. In vivo er kondrocytter spredt plassert i ECM og er ikke i kontakt med hverandre. Leddbrusk-eksplantasjonskulturen bevarer denne strukturelle organiseringen, så vel som de spesifikke interaksjonene mellom kondrocytter og det omkringliggende ekstracellulære miljøet. Denne modellen brukes også til å studere effektene av mekanisk stress, farmakologiske midler, vekstfaktorer, cytokiner og hormoner på bruskmetabolismen.
En annen fordel med eksplantasjon av bruskvev er fraværet av skade på kondrocytter under påvirkning av proteolytiske enzymer eller mekaniske faktorer, noe som er uunngåelig når man isolerer celler. Reseptorer og andre membranproteiner og glykoproteiner er beskyttet mot skadelige faktorer.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Kondronkultur
Kondron er en strukturell, funksjonell og metabolsk enhet i leddbrusk som består av en kondrocytt, dens pericellulære matriks og kompakte filamentøse kapsel, og som er ansvarlig for matrikshomeostase. Kondroner ekstraheres mekanisk fra brusk og samles opp ved hjelp av flere påfølgende lavhastighetshomogeniseringer. Kondroner isolert fra soner med ulik bruskdybde kan deles inn i fire kategorier: enkelt kondron, parede kondroner, flere (tre eller flere) lineært arrangerte kondroner (kondronsøyler) og kondronklynger.
Enkle kondroner finnes vanligvis i de midterste lagene av intakt brusk, parede kondroner finnes ved grensen mellom de midterste og dype lagene, og lineært arrangerte flere kondroner er typiske for de dype lagene av intakt brusk. Til slutt består kondronklynger av tilfeldig organiserte grupper av enkle og parede kondroner, som beholder en aggregert tilstand etter homogenisering. Kondronklynger er store fragmenter av brusk, vanligvis inneholdende flere kondroner og radielt arrangerte kollagenfibriller, dvs. en typisk organisering som er karakteristisk for de dype lagene i matriksen. Kondroner er immobilisert i transparent agarose, noe som muliggjør studier av deres struktur, molekylære sammensetning og metabolske aktivitet. Kondron-agarosesystemet regnes som en mikromodell av brusk, som skiller seg fra det tradisjonelle kondrocyt-agarosesystemet ved at det naturlige mikromiljøet bevares, og det er ikke behov for å syntetisere og sette det sammen. Kondronkultur er en modell for å studere interaksjonene mellom celler og matriks i leddbrusk under normale og patologiske forhold.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Kultur av udødelige kondrocytter
Rekombinant DNA eller onkogenholdige virus som er i stand til å gjøre en celle "udødelig" brukes til å lage permanente cellelinjer. Udødelige kondrocytter har evnen til å proliferere uendelig samtidig som de opprettholder en stabil fenotype. F. Mallein-Gerin et al. (1995) viste at SV40T-onkogenet induserer proliferasjon av musekondrocytter, som fortsetter å stabilt uttrykke kollagen type II, IX og XI, samt artikulær aggrekan og bindende protein. Imidlertid tilegner en slik cellelinje seg evnen til å syntetisere kollagen type I når den dyrkes i en monolagskultur eller i en agarosegel.
W. Horton et al. (1988) beskrev en linje med udødelige celler med lavt uttrykk av type II kollagen mRNA. Disse cellene ble oppnådd ved transformasjon med et museretrovirus som inneholdt I-myc- og y-ra-onkogener. Denne celletypen representerer en unik modell for å studere interaksjonene i den artikulære matriksen i fravær av type II kollagen, samt reguleringen av type II kollagensyntese.
Kultur av kondropritter med muterte eller deleterte gener er en praktisk modell for å studere deres fysiologiske funksjon. Denne modellen er spesielt egnet for å studere rollen til spesifikke molekyler i organiseringen av bruskmatrisen eller for å undersøke effekten av ulike regulatoriske faktorer på bruskmetabolismen. Kondrocytter med et deletert gen for type IX-kollagen syntetiserer kollagenfibriller som er bredere enn normalt, noe som indikerer at type IX-kollagen regulerer diameteren til fibrillene. Som nevnt i kapittel 1, har en mutasjon i COLAI-genet som koder for type II-kollagen nylig blitt oppdaget i familier med primær generalisert artrose. For å studere effekten av mutant type II-kollagen på leddmatrisen, transfekterte R. Dharmrvaram et al. (1997) (infiserte med fremmed nukleinsyre) defekte COL 2 AI (arginin i posisjon 519 er erstattet av cystein) inn i humane føtale kondrocytter in vitro.
Kokultursystem. I leddet samhandler brusk med andre typer celler som finnes i synovialmembranen, synovialvæsken, leddbåndene og subkondralt bein. Metabolismen til kondrocytter kan påvirkes av ulike løselige faktorer syntetisert av de listede cellene. Ved leddgikt ødelegges dermed leddbrusk av proteolytiske enzymer og frie radikaler produsert av synovialceller. Derfor er det utviklet modeller for å studere komplekse interaksjoner mellom brusk og omkringliggende vev, som kalles kokulturer.
S. Lacombe-Gleise et al. (1995) dyrket kaninkondrocytter og osteoblaster i et samkultursystem (COSTAR) der cellene var separert av en mikroporøs membran (0,4 μm) som tillot utveksling mellom de to celletypene uten direkte kontakt. Denne studien demonstrerte osteoblasters evne til å stimulere kondrocyttvekst via løselige mediatorer.
AM Malfait og medforfattere (1994) studerte forholdet mellom perifere blodmonocytter og kondrocytter. Denne modellen er praktisk for å studere cytokinmedierte prosesser ved inflammatoriske artropatier (revmatoid artritt, seronegative spondyloartritt, etc.). Forfatterne av modellen separerte cellene med en proteinbindende membran med porer på 0,4 μm i diameter. Studien viste at monocytter stimulert med lipopolysakkarid produserte IL-1 og TNF-α, som hemmet syntesen av aggrecan av kondrocytter og bidro til nedbrytningen av allerede syntetiserte aggrecanaggregater.
K. Tada et al. (1994) laget en samkulturmodell der endotelceller i en kollagengel (type I) ble plassert i et indre kammer atskilt fra det ytre kammeret, med kondrocytter plassert i det av et filter med en porestørrelse på 0,4 μm. I en tilstand av fullstendig isolasjon fra det ytre kammeret dannet humane endotelceller rør i en kollagengel i nærvær av EGF eller TGF-a. Når begge celletypene ble dyrket samtidig, ble TGF-a-avhengig rørdannelse av endotelceller hemmet. Hemming av denne prosessen av kondrocytter ble delvis eliminert av anti-TGF-beta-antistoffer. Det kan antas at TGF-beta produsert av kondrocytter hemmer vaskularisering av selve brusken.
S. Groot et al. (1994) dyrket samtidig kondrocytter fra de hypertrofiske og proliferative sonene i beinet til et 16 dager gammelt musefoster med biter av hjernevev. Etter 4 dager med dyrking ble transdifferensiering av kondrocytter til osteoblaster og begynnelsen av osteoiddannelse observert. Etter 11 dager med dyrking var deler av brusken erstattet av beinvev, og beinmatrisen var delvis forkalket. Noen nevropeptider og nevrotransmittere produsert av hjernevev påvirker metabolismen til osteoblaster eller har reseptorer for dem. Blant dem er noradrenalin, vasoaktivt intestinalt peptid, kalsitonin-genrelatert peptid, substans P og somatostatin. Biter av hjernevev dyrket sammen med kondrocytter kan produsere noen av de listede faktorene som er i stand til å indusere prosessen med transdifferensiering av kondrocytter til osteoblaster.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Innflytelsen av eksterne faktorer på kondrocytkultur
Innflytelsen av oksygentrykk på kondrocyttmetabolisme
I de fleste tilfeller utvikler kondrocyttkulturer seg under forhold med atmosfærisk oksygentrykk. Det er imidlertid velkjent at in vivo-kondrocytter eksisterer under hypoksiske forhold, og oksygentrykket varierer under ulike patologiske forhold. Under modningsprosessen observeres betydelige endringer i blodtilførselen til epifysene. Siden vaskulariseringen varierer i forskjellige soner av vekstplaten, varierer også oksygentrykket i dem. C. Brighton og R. Heppenstall (1971) demonstrerte at i tibialplaten hos kaniner er oksygentrykket i den hypertrofiske sonen lavere enn i den omkringliggende brusken. Målinger av noen metabolske parametere viste at kondrocytter er i stand til å reagere raskt på lokale endringer i oksygenkonsentrasjonen. Først og fremst, ved lavt oksygentrykk, reduseres forbruket av kondrocytter. Med en reduksjon i oksygentrykk fra 21 til 0,04 % øker glukoseutnyttelsen, aktiviteten til glykolytiske enzymer og syntesen av melkesyre øker. Selv ved lavt oksygentrykk forblir den absolutte mengden ATP, ADP og AMP stabil. Disse dataene indikerer at kondrocyttmetabolismen er rettet mot maksimal energibevaring. Imidlertid endres syntetisk aktivitet, og dermed reparasjonsprosesser, under hypoksiske forhold.
Høyt oksygentrykk påvirker også kondrocyttmetabolismen, noe som forårsaker en reduksjon i proteoglykan- og DNA-syntese og nedbrytning av bruskmatrisen. Disse effektene er vanligvis ledsaget av produksjon av frie oksygenradikaler.
Påvirkningen av ionkonsentrasjon og osmotisk trykk i miljøet på kondrocyttfunksjonen
I naturlig brusk er konsentrasjonen av ioner betydelig forskjellig fra den i andre vev: natriuminnholdet i det ekstracellulære mediet er 250–350 mmol, og osmolariteten er 350–450 mosmol. Når kondrocytter isoleres fra ECM og inkuberes i standardmedium (DMEM (Dulbeccos minimale essensielle medium), osmolariteten er 250–280,7 mosmol), endres miljøet rundt cellene dramatisk. I tillegg er konsentrasjonen av kalsium og kalium i standardmedium betydelig lavere enn i naturlig vev, og konsentrasjonen av anioner er betydelig høyere.
Tilsetning av sukrose til mediet øker dets osmolaritet og induserer en forbigående intracellulær økning i konsentrasjonen av H + og kalsiumanioner i cytosolen. Slike intracellulære endringer kan påvirke prosessene for kondrocyttdifferensiering og deres metabolske aktivitet. J. Urban et al. (1993) fant at inkorporeringen av 358 -sulfat og 3H -prolin av isolerte kondrocytter inkubert i standard DMEM i 2–4 timer bare var 10 % av den i nativt vev. Synteseintensiteten nådde et maksimum ved en osmolaritet i det ekstracellulære mediet på 350–400 mosmol både i nylig isolerte kondrocytter og i bruskvevseksplanter. Dessuten økte volumet av kondrocytter med 30–40 % etter at de isolerte cellene ble plassert i standard DMEM med den spesifiserte osmolariteten. Når kondrocytter dyrkes under forhold med ikke-fysiologisk osmolaritet i 12–16 timer, tilpasser cellene seg imidlertid de nye forholdene, og reduserer intensiteten av biosyntesen i forhold til endringen i osmolaritet i det ekstracellulære miljøet.
P. Borgetti et al. (1995) studerte effekten av osmolaritet i ekstracellulært medium på vekst, morfologi og biosyntese av grisekondrocytter. Forfatterne demonstrerte lignende biokjemiske og morfologiske trekk hos kondrocytter dyrket i medier med osmolaritet på 0,28 og 0,38 mosmol. Ved en middels osmolaritet på 0,48 mosmol ble det observert en reduksjon i celleproliferasjon og proteinsyntese i løpet av de første 4–6 timene av dyrkingen, men disse parameterne gjenopprettet seg deretter og nådde til slutt kontrollverdier. Når kondrocytter ble dyrket i et medium med en osmolaritet på 0,58 mosmol, mistet cellene evnen til å opprettholde den fysiologiske intensiteten til proliferative prosesser, og etter 6 dager var antallet kondrocytter betydelig redusert. Ved en middels osmolaritet på 0,58 mosmol ble det observert en betydelig hemming av proteinsyntese. I tillegg, når kondrocytter dyrkes i medier med en osmolaritet på 0,28–0,38 mOsm, beholder de sin fysiologiske fenotype; ved høyere osmolaritet (0,48–0,58 mOsm) oppstår det betydelige endringer i cellemorfologien, noe som manifesterer seg ved tap av den karakteristiske fenotypen, transformasjon av kondrocytter til fibroblastlignende celler og tap av cellenes evne til å sette sammen matriksproteoglykaner. Resultatene av denne studien indikerer kondrocytters evne til å reagere på begrensede svingninger i osmolariteten i det ekstracellulære miljøet.
Endringer i konsentrasjonen av andre ioner kan også påvirke biosynteseprosessene i kondrocytter. Dermed øker graden av 35S (sulfat)-inkorporering med halvparten med en økning i konsentrasjonen av kaliumioner fra 5 mmol (konsentrasjonen i standard DM EM-medium) til 10 mmol (konsentrasjonen i ECM in vivo). Kalsiumkonsentrasjoner under 0,5 mmol fremmet kollagenproduksjon av modne bovine kondrocytter, mens en konsentrasjon på 1–2 mmol (tilsvarende konsentrasjonen i standard DM EM-medium) forårsaket en betydelig reduksjon i kollagensyntesen. En moderat økning i biosyntesen ble observert ved høye kalsiumnivåer (2–10 mmol). Ulike kationer deltar i kondrocytters binding til ECM-proteiner. Dermed gir magnesium- og manganioner binding til fibronektin og type II-kollagen, mens kalsiumioner ikke deltar i kondrocytters binding til proteiner. Resultatene fra de beskrevne studiene indikerer dermed påvirkningen av endringer i ekstracellulære ioner av kalium, natrium, kalsium og osmolaritet i mediet på den biosyntetiske funksjonen til kondrocytter inkubert i standardmedium.
Effekt av mekanisk stress på kondrocyttmetabolisme
Leddimmobilisering forårsaker reversibel bruskatrofi, noe som indikerer behov for mekaniske stimuli for normale metabolske prosesser i ECM. I de fleste tilfeller eksisterer cellekulturmodellene som brukes under normalt atmosfærisk trykk. M. Wright et al. (1996) viste at det mekaniske miljøet påvirker kondrocytters metabolisme, celleresponsen avhenger av intensiteten og hyppigheten av trykkbelastning. Eksperimenter med belastning på eksplantater av intakt leddbrusk in vitro viste en reduksjon i syntesen av proteiner og proteoglykaner under påvirkning av statisk belastning, mens dynamisk belastning stimulerer disse prosessene. De eksakte mekanismene for effekten av mekanisk belastning på brusk er komplekse og er sannsynligvis assosiert med celledeformasjon, hydrostatisk trykk, osmotisk trykk, elektrisk potensial og overflatecellulære reseptorer for matriksmolekyler. For å studere effekten av hver av disse parameterne er det nødvendig å lage et system der én parameter kan varieres uavhengig. For eksempel er eksplantatkultur ikke egnet for å studere celledeformasjon, men den kan brukes til å studere den generelle effekten av trykk på den metabolske aktiviteten til kondrocytter. Kompresjon av brusk fører til celledeformasjon og ledsages også av fremveksten av en hydrostatisk trykkgradient, elektrisk potensial, væskestrøm og endringer i slike fysikalsk-kjemiske parametere som vanninnhold i matrisen, elektrisk ladningstetthet og osmotisk trykknivå. Celledeformasjon kan studeres ved hjelp av isolerte kondrocytter nedsenket i agarose- eller kollagengel.
Flere systemer har blitt utviklet for å studere effekten av mekanisk stimulering på kondrocyttkultur. Noen forskere bruker systemer der trykk påføres cellekulturen gjennom gassfasen. JP Veldhuijzen et al. (1979) observerte dermed en økning i syntesen av cAMP og proteoglykaner og en reduksjon i DNA-syntese ved bruk av et trykk på 13 kPa over atmosfærisk trykk med lav frekvens (0,3 Hz) i 15 minutter. R. Smith et al. (1996) viste at intermitterende eksponering av en kultur av primære bovine kondrocytter for hydrostatisk trykk (10 MPa) med en frekvens på 1 Hz i 4 timer forårsaket en økning i syntesen av aggrecan og type II-kollagen, mens konstant trykk ikke påvirket disse prosessene. Ved bruk av et lignende system rapporterte Wright et al. (1996) at syklisk trykk på cellekultur er assosiert med hyperpolarisering av kondrocyttcellemembranen og aktivering av Ca2 + -avhengige kaliumkanaler. Effektene av syklisk trykk medieres dermed av strekkaktiverte ionekanaler i kondrocyttmembranen. Kondrocytters respons på hydrostatisk trykk avhenger av cellekulturforholdene og frekvensen av den påførte belastningen. Syklisk hydrostatisk trykk (5 MPa) reduserer dermed sulfatinnlemmelsen i kondrocyttmonolaget ved en frekvens på 0,05, 0,25 og 0,5 Hz, mens sulfatinnlemmelsen i bruskeksplantatet øker ved en frekvens større enn 0,5 Hz.
M. Bushmann et al. (1992) rapporterte at kondrocytter i agarosegeler endrer biosyntesen som respons på statisk og dynamisk mekanisk belastning på samme måte som det dyrkede intakte organet. Forfatterne fant at mekanisk belastning genererer en hyperosmotisk stimulus med en påfølgende reduksjon i pH i kondrocytter.
Effekten av mekanisk strekking kan studeres på en cellekultur nedsenket i en gel. Strekkkraften kan opprettes ved hjelp av et datastyrt vakuum. Når systemet er under en viss grad av vakuum, forlenges bunnen av petriskålen med cellekulturen med en kjent mengde, deformasjonen er maksimal ved kantene av bunnen av skålen og minimal i midten. Strekket overføres også til kondrocyttene dyrket i petriskålen. Ved hjelp av denne metoden viste K. Holm-vall et al. (1995) at i kondrosarkomceller dyrket i en kollagen (type II) gel, økes uttrykket av mRNA til et 2β-integrin . Et 2β-integrin er i stand til å binde seg til type II-kollagen. Det regnes som en mekanoreseptor, siden det samhandler med aktinbindende proteiner, og dermed forbinder ECM og cytoskjelettet.
Effekten av pH på kondrocyttmetabolisme
PH-en i interstitiellvæsken i ECM i bruskvev er surere enn i andre vev. A. Maroudas (1980) bestemte pH-en i leddbruskmatrisen til 6,9. B. Diamant et al. (1966) fant en pH på 5,5 under patologiske forhold. Det er kjent at kondrocytter lever ved lav PO2, noe som indikerer den viktige rollen glykolysen (95 % av all glukosemetabolisme) spiller i metabolismen til disse cellene; glykolysen ledsages av produksjon av en stor mengde melkesyre.
I tillegg til forsuring av miljøet av glykolyseprodukter, er selve matrikskomponentene av stor betydning. Den store mengden fast negativ ladning på proteoglykaner modifiserer den ekstracellulære ioniske sammensetningen: en høy konsentrasjon av frie kationer (f.eks. H +, Na +, K + ) og en lav konsentrasjon av anioner (f.eks. O2, HCO3) observeres. I tillegg, under påvirkning av mekanisk belastning, utstøtes vann fra ECM, noe som fører til en økning i konsentrasjonen av faste negative ladninger og tiltrekning av flere kationer inn i matriksen. Dette er ledsaget av en reduksjon i pH-verdien i det ekstracellulære miljøet, som påvirker den intracellulære pH-verdien, og dermed modifiserer metabolismen til kondrocytter. R. Wilkin og A. Hall (1995) studerte effekten av pH-verdien i det ekstracellulære og intracellulære miljøet på biosyntesen av matriksen av isolerte bovine kondrocytter. De observerte en dobbel modifisering av matrikssyntesen med en reduksjon i pH. En liten reduksjon i pH (7,4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Påvirkningen av kulturmediets sammensetning på metabolismen av kondrocytter
Mediet for dyrking av kondrocytter må samsvare med de eksperimentelle forholdene. I de senere årene har kalveserum blitt brukt for å optimalisere dyrkingsbetingelsene. Ved bruk av serum må imidlertid en rekke viktige punkter tas i betraktning:
- utovervekst av celler fra periferien av vev i organkulturer,
- variasjon i sammensetningen av serum fra forskjellige serier,
- tilstedeværelsen av ukjente komponenter i dem,
- økt risiko for interferens og artefakter når man studerer påvirkningen av ulike biologiske faktorer på cellenes metabolske aktivitet.
Et eksempel på sistnevnte er en studie av effekten av EGF på bruskkondrocytter hos rotter. EGF stimulerte inkorporeringen av 3H -tymidin og en økning i DNA-innhold i kulturen. Denne effekten var mer uttalt ved lave serumkonsentrasjoner (<1 %), men ved høye konsentrasjoner (>7,5 %) forsvant effekten.
Det er velkjent at syntese- og nedbrytningsnivåene i DMEM tilsatt kalveserum er betydelig økt sammenlignet med in vivo-forhold. Forskjeller mellom in vivo- og in vitro-metabolisme kan skyldes forskjeller mellom synovialvæsken og mediet cellene dyrkes i. Lee et al. (1997) dyrket unge bovine kondrocytter i agarose ved bruk av et næringsmedium som inneholdt DMEM tilsatt 20 % kalveserum og en stor mengde normal allogen synovialvæske. Tilstedeværelsen av synovialvæske i mediet induserte en økning i mengden proteoglykaner, opptil 80 % av den totale mengden synovialvæske. Disse resultatene indikerer at synovialvæske i kultur induserer et metabolismenivå som ligner på det in vivo, med et høyt nivå av glykosaminoglykansyntese og et lavt nivå av celledeling.
G. Verbruggen et al. (1995) viste at 35S -arrpeKaHa-syntese av humane kondrocytter dyrket i agarose i serumfritt DMEM var 20–30 % av syntesenivået observert i DMEM tilsatt 10 % kalveserum. Forfatterne bestemte i hvilken grad IGF-1, IGF-2, TGF-R eller insulin gjenopprettet aggrecanproduksjonen i serumfritt medium. Forfatterne konkluderte med at 100 ng/ml insulin, IGF-1 eller IGF-2 delvis gjenopprettet aggrecansyntesen til 39–53 % av kontrollnivået. Ingen synergisme eller kumulasjon ble observert med en kombinasjon av de listede faktorene. Samtidig stimulerte 10 ng/ml TGF-R i nærvær av 100 ng/ml insulin aggrecansyntesen til 90 % eller mer av referansenivået. Til slutt påvirket ikke humant serumtransferrin, alene eller i kombinasjon med insulin, aggrecansyntesen. Da kalveserum ble erstattet med bovint serumalbumin, sank innholdet av aggrekanaggregater betydelig. Berikelse av kulturmediet med insulin, IGF eller TGF-R gjenopprettet delvis cellenes evne til å produsere aggrekanaggregater. Dessuten er IGF-1 og insulin i stand til å opprettholde homeostase i cellekulturer. Etter 40 dager med dyrking i et medium beriket med 10–20 ng/ml IGF-1, ble proteoglykansyntesen opprettholdt på samme nivå eller enda høyere sammenlignet med mediet som inneholdt 20 % kalveserum. Katabolske prosesser forløp saktere i mediet beriket med IGF-1 enn i mediet beriket med 0,1 % albuminløsning, men noe raskere i mediet beriket med 20 % serum. I kulturer med lang levetid opprettholder 20 ng/ml IGF-1 en stabil celletilstand.
D. Lee et al. (1993) sammenlignet effekten av kulturmediumsammensetningen (DMEM, DMEM + 20 % kalveserum, DMEM + 20 ng/ml IGF-1) på DNA-syntese i en bruskvevseksplantasjonskultur, en monolagskultur og i agarosesuspensjon. Ved dyrking i agarose i nærvær av serum observerte forfatterne en tendens til at kondrocytter grupperte seg i store klynger. Celler dyrket uten serum eller med IGF-1 beholdt en rund form i agarose, samlet i små grupper, men dannet ikke store aggregater. I et monolag var DNA-syntesen betydelig høyere i det serumholdige mediet enn i mediet beriket med IGF-1; DNA-syntesen i sistnevnte var betydelig høyere enn i det ikke-anrikede mediet. Ingen forskjeller i DNA-syntese ble funnet når kondrocytter ble dyrket i agarosesuspensjon i et ikke-anriket medium og i et medium med IGF-1. Samtidig ble dyrking av kondrocytsuspensjoner i agarose i et serumanriket medium ledsaget av økt inkorporering av radionukleotidet 3H -tymidin sammenlignet med andre medier.
Vitamin C er nødvendig for aktivering av enzymer involvert i dannelsen av en stabil spiralformet struktur av kollagenfibriller. Kondrocytter som mangler askorbinsyre syntetiserer underhydroksylerte ikke-spiralformede kollagenforløpere, som skilles ut sakte. Administrering av askorbinsyre (50 μg/ml) forårsaker hydroksylering av kollagen type II og IX og deres utskillelse i normale mengder. Tilsetning av vitamin C påvirket ikke nivået av proteoglykansyntese. Derfor reguleres kollagensekresjon uavhengig av proteoglykansekresjon.

