Nye publikasjoner
"Oksygen for celler": et enkelt implantat bidro til å senke sukkernivået uten sterke medisiner
Sist anmeldt: 18.08.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
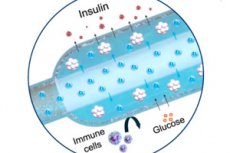
Et nytt «oksygen»-implantat for behandling av type 1-diabetes ble beskrevet i Nature Communications: en kompakt elektrokjemisk oksygengenerator (iEOG) forsyner kontinuerlig O₂ til en makrokapsel med insulinutskillende celler. Dette systemet muliggjør tett pakning av isolerte øyer (opptil 60 000 IEQ/ml) og opprettholder deres levedyktighet og utskillelse selv under forhold med lite oksygen. Hos rotter med diabetes opprettholdt enheten implantert under huden normalt sukker i opptil tre måneder – uten immunsuppresjon. Kontrollrotter, uten oksygen, forble hyperglykemiske.
Bakgrunn
- Det største tekniske problemet er oksygen. Så snart vi «gjemmer» cellene bak membranen og plasserer enheten under huden (praktisk og enkelt ekstrahert), mangler de oksygen: diffusjonen gjennom membranen og det dårlig vaskulære stedet dekker ikke behovene til de «glupske» øyene. Derfor den tidlige døden, det svake arbeidet og behovet for å tynne ut såingen kraftig – ellers blir kapselen enorm.
- Hvorfor er det så fysisk vanskelig? Oksygen passerer bare gjennom vev over svært korte avstander, og innkapslede celler har ikke egne kar – de første månedene lever de kun på grunn av passiv diffusjon. Enhver fortykkelse av materialer eller "komprimering" av celler fører raskt til hypoksi i midten av kapselen.
- Hva har du prøvd før?
- De lagde makroenheter som kan etterfylles med oksygen (for eksempel βAir): det er et reservoar inni som etterfylles med oksygen daglig; det ble gjennomført prekliniske og tidlige kliniske studier. Det fungerer, men det er arbeidskrevende for pasienten.
- Kjemiske O₂-donorer og "bærer"-materialer (perfluorforbindelser) ble prøvd: de hjelper, men gir en kort og vanskelig å kontrollere effekt. "Luft"-rammer for å akselerere O₂-tilførselen inn i gelens tykkelse dukket også opp.
- Selve kapslene og implantasjonsstedene (tynne membraner, prevaskularisering) ble forbedret, men uten en ekstern O₂-kilde støter de fortsatt på grensene for celletetthet.
- Hvilket gap i puslespillet fyller det nye arbeidet? Forfatterne av Nature Communications viser en kontinuerlig tilførsel av oksygen fra en minigenerator rett inne i makroinnkapslingssystemet: enheten tar vann fra vevet og frigjør elektrokjemisk O₂, som jevnt «puster» langs kapselen med celler. Tanken er å gi kapselen sin «egen akvariekompressor» slik at den kan pakke flere celler og fortsatt holde dem i live og i drift – selv på et subkutant, ikke veldig «oksygenert» sted.
Hvorfor er dette i det hele tatt nødvendig?
Øy- eller betacelletransplantasjon er en av de mest lovende veiene til en «funksjonell kur» for type 1-diabetes. Men det finnes to store barrierer:
- Immunitet - krever vanligvis livslange immunsuppressiva;
- Oksygenmangel – kapsler som beskytter immunforsvaret, kutter samtidig celler fra blodårene, og betaceller, som er glupske etter O₂, «kveles» raskt. Det nye arbeidet treffer den andre barrieren: det gir kapselen sin egen, kontrollerte oksygenkilde.
Hvordan implantatet fungerer
- To deler. I et titanhus er det en mini-oksygengenerator (iEOG), som utvinner vann fra interstitiellvæsken og frigjør O₂ ved elektrolyse; ved siden av er det en tynn lineær kapsel med celler (ligner på en lang "pølse"), gjennom hvilken et gasspermeabelt rør passerer: oksygen absorberes jevnt langs hele kapselen. Mellom cellene og vevet er det en semipermeabel membran (elektrospinn + alginat): glukose og insulin passerer gjennom, immunceller gjør det ikke.
- Dimensjoner: Den andre versjonen av iEOG er 13 mm i diameter og 3,1 mm tykk, og veier omtrent 2 g. Når det kombineres med en kapsel, kan et slikt system settes inn og fjernes gjennom et lite snitt, noe som er viktig for sikkerheten.
- Produktivitet. Generatoren produserer ~1,9–2,3 cm³ O₂/t og opprettholder den spesifiserte strømmen i måneder og til og med år (i langtidsprøver i saltvannsløsning – opptil 2,5 år), og etter implantasjon i rotter ble dette nivået opprettholdt. En slik strøm er beregnet til å dekke behovet til hundretusenvis av øyekvivalenter – den størrelsesordenen en person trenger.
Hva eksperimentene viste
- In vitro: Ved 1 % O₂ (alvorlig hypoksi) opprettholdt oksygeneringen levedyktighet og sekresjon i INS-1-aggregater og i humane øyer pakket i et svært tett lag (60 000 IEQ/ml).
- In vivo (rotter). Etter subkutan implantasjon i en allogen diabetesmodell normaliserte iEOG-systemet glykemi i opptil 3 måneder uten immunsuppresjon; apparater uten oksygen hadde ingen effekt. Histologi rundt generatoren viste ingen signifikante bivirkninger.
Hvorfor er dette viktig for klinikken?
- Et skritt mot «realistiske dimensjoner». For å gi en voksen en dose på 300–770 tusen IEQ, må kapselen være tettpakket – dette har alltid vært begrenset av oksygen. Kontrollert O₂-tilførsel «fjerner taket» på tetthet og gir en mulighet til å gjøre enheten kompakt nok for reell implantasjon.
- Pluss bekvemmelighet. Tidligere prøvde vi kjemiske oksygendonorer (peroksider) – de virker ikke lenge og er ukontrollerbare, samt O₂-reservoarer med daglig "påfylling" gjennom huden – tungvint og upraktisk. Her tilføres oksygen konstant og i målte doser, uten injeksjoner.
Tekniske detaljer som imponerer
- Vannkilden er vev. iEOG tar inn dampen fra interstitiell væske gjennom et porøst «vindu», og deretter brukes en klassisk membran-elektrode-enhet (MEA) og en spenning på 1,4–1,8 V til å separere vann til H₂ og O₂; gasser fjernes gjennom forskjellige kanaler.
- Holdbarhet. Tre enheter i saltvannsløsning opererte i 11 måneder, 2 år og 2,5 år på likestrøm uten nedbrytning av oksygenstrøm. Etter implantasjon i immunsviktige og immunkompetente rotter ble ytelsen opprettholdt.
Begrensninger og «hva nå»
Dette er fortsatt preklinisk: rotter, høy tetthet i kapselen, oksygentilførsel – alt er flott, men viktige tester ligger foran oss:
- skalering til menneskelige doser og tidsrammer;
- pålitelighet og strømforsyning av elektrokjemikere i menneskekroppen i årevis (strømforsyningsarkitekturen er ikke detaljert beskrevet i artikkelen);
- minimering av fibrose rundt kapslene og diffusjonsstabilitet;
- testing på beta-stamceller og i modeller som ligner mer på mennesker. Forfatterne sammenligner åpent løsningen sin med tidligere tilnærminger og posisjonerer den som en plattform for klinisk oversettelige kapsler.
Konklusjon
For at transplanterte betaceller skal kunne leve og fungere uten immunsuppressiva, må de puste. Teamet fra Cornell og partnere viste at en mini-oksygengenerator innebygd i en lineær kapsel kan «mate» celler med O₂ lenge nok og jevnt nok til at de tåler høy tetthet og reduserer sukker selv på et subkutant sted. Klinikken er fortsatt langt unna, men den tekniske logikken er enkel og vakker – gi cellene luft der det mangler.
