Nye publikasjoner
ARID1A-genmutasjon gjør svulster følsomme for immunterapi
Sist anmeldt: 02.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Immunterapi har revolusjonert kreftbehandlingen de siste årene. I stedet for å målrette svulster direkte, styrer immunterapi pasientenes immunsystem til å angripe svulster mer effektivt. Dette er spesielt effektivt for noen vanskelig behandlelige kreftformer. Imidlertid responderer mindre enn halvparten av alle kreftpasienter på dagens immunterapier, noe som skaper et presserende behov for å identifisere biomarkører som kan forutsi hvilke pasienter som mest sannsynlig vil ha nytte av behandlingen.
Nylig har forskere lagt merke til at pasienter med svulster som har en mutasjon i ARID1A-genet, har større sannsynlighet for å reagere positivt på immunkontrollpunktblokade, en type immunterapi som virker ved å holde kreftbekjempende immunceller aktivert.
Fordi ARID1A-genmutasjonen er tilstede i mange kreftformer, inkludert endometrie-, eggstok-, kolorektal-, mage-, lever- og bukspyttkjertelkreft, lurte forskere ved Salk Institute på hvordan det kunne bidra til behandlingsfølsomhet og hvordan klinikere kunne bruke denne informasjonen til å tilpasse kreftbehandlingen for hver pasient.
Deres nye studie, publisert i tidsskriftet Cell, viser at ARID1A-mutasjonen gjør svulster følsomme for immunterapi ved å rekruttere kreftbekjempende immunceller til svulsten gjennom en antivirallignende immunrespons.
Forskerne antyder at denne mutasjonen og den antivirale immunresponsen kan brukes som en biomarkør for å bedre velge pasienter for spesifikke immunterapier, som for eksempel immunkontrollpunktblokade. Disse funnene oppmuntrer også til utvikling av legemidler som er rettet mot ARID1A og relaterte proteiner for å gjøre andre svulster mer følsomme for immunterapi.
«Dette kan virkelig endre utfallet av kreftbehandling for pasienter», sa førsteamanuensis Diana Hargreaves, seniorforfatter av studien. «Pasienter med ARID1A-mutasjonen har allerede en immunrespons, så alt vi trenger å gjøre er å forsterke den responsen med immunkontrollpunktblokade for å hjelpe dem med å ødelegge svulstene sine fra innsiden.»
Selv om det var kjent at personer med ARID1A-mutasjoner responderte godt på immunkontrollpunktblokade, forble den eksakte sammenhengen mellom de to uklar. For å belyse mekanismen brukte forskere ved Salk Institute musemodeller av melanom og kolorektal kreft med både ARID1A-mutasjonen og funksjonell ARID1A.
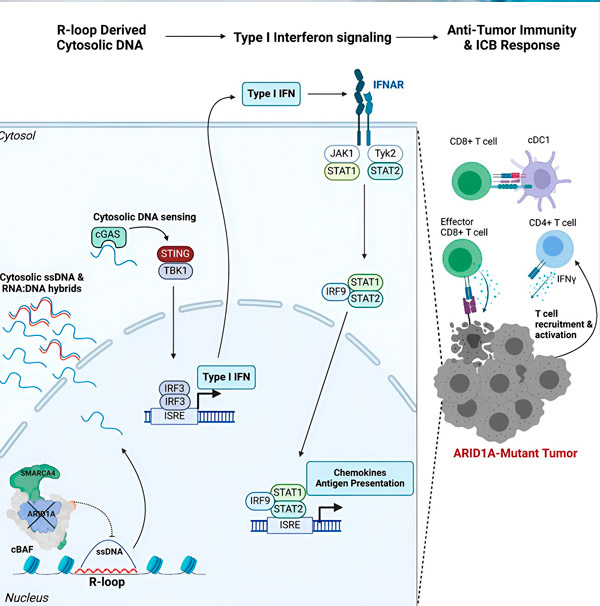
Kilde: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Teamet observerte en robust immunrespons i alle modeller med ARID1A-mutasjonen, men ikke i de der ARID1A var funksjonell, noe som støtter ideen om at ARID1A-mutasjonen faktisk driver denne responsen. Men hvordan fungerer dette på molekylært nivå?
«Vi fant ut at ARID1A spiller en viktig rolle i kjernen ved å opprettholde riktig DNA-organisering», sier Matthew Maxwell, førsteforfatter av studien og en masterstudent ved Hargreaves-laboratoriet. «Uten funksjonell ARID1A kan fritt DNA fjernes og frigjøres i cytosolen, noe som aktiverer en ønskelig antiviral immunrespons som kan forsterkes ved immunkontrollpunktblokade.»
ARID1A-genet koder for et protein som bidrar til å regulere formen på DNA-et vårt og opprettholde genomstabilitet. Når ARID1A muterer, setter det i gang en Rube-Goldberg-lignende kjede av hendelser i kreftceller.
For det første fører mangelen på funksjonell ARID1A til at DNA frigjøres til cytosolen. Det cytosoliske DNAet aktiverer deretter et antiviralt alarmsystem, cGAS-STING-signalveien, fordi cellene våre er tilpasset til å markere ethvert DNA i cytosolen som fremmed for å beskytte mot virusinfeksjoner. Til syvende og sist engasjerer cGAS-STING-signalveien immunforsvaret til å rekruttere T-celler til svulsten og aktivere dem til spesialiserte kreftdrepende T-celler.
Ved hvert trinn, avhengig av det forrige, fører denne hendelseskjeden – ARID1A-mutasjon, DNA-rømning, cGAS-STING-alarm, T-celle-rekruttering – til en økning i antallet kreftbekjempende T-celler i svulsten. Blokkering av immunkontrollpunkter kan deretter brukes til å sikre at disse T-cellene forblir aktiverte, noe som forbedrer deres evne til å bekjempe kreft.
«Funnene våre gir en ny molekylær mekanisme der en ARID1A-mutasjon kan bidra til en antitumorimmunrespons», sier Hargreaves. «Det som er spennende med disse funnene er deres translasjonspotensial. Vi kan bruke ARID1A-mutasjoner til å velge pasienter for immunkontrollpunktblokade, og vi ser nå en mekanisme der legemidler som hemmer ARID1A eller dets proteinkompleks kan brukes til å forbedre immunterapi ytterligere hos andre pasienter.»
Ved å beskrive mekanismen som gjør at immunkontrollpunktblokade er mer effektiv ved ARID1A-muterte kreftformer, gir forskerne klinikere en begrunnelse for å prioritere denne immunterapien for pasienter med en ARID1A-mutasjon. Disse funnene er et viktig skritt mot å persontilpasse kreftbehandling og inspirerer utviklingen av nye terapier som er rettet mot ARID1A og dets proteinkompleks.
Salk Institute-teamet håper at funnene deres vil forbedre behandlingsresultatene for pasienter med ulike typer kreft assosiert med ARID1A-mutasjoner fremover, og har til hensikt å utforske denne kliniske oversettelsen i samarbeid med University of California, San Diego.
