Nye publikasjoner
Aktivering av medfødt immunitet: en viktig del av mekanismen som er identifisert
Sist anmeldt: 02.07.2025

Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Forskere fra LMU har dechiffrert det komplekse samspillet mellom ulike enzymer rundt den medfødte immunreseptoren Toll-lignende reseptor 7 (TLR7), som spiller en viktig rolle i å beskytte kroppen vår mot virus.
Toll-lignende reseptor 7 (TLR7), som ligger på dendrittiske celler i immunsystemet vårt, spiller en kritisk rolle i vårt naturlige forsvar mot virus. TLR7 gjenkjenner enkelttrådet viralt RNA og annet fremmed RNA og aktiverer frigjøringen av inflammatoriske mediatorer. Dysfunksjoner i denne reseptoren spiller også en nøkkelrolle i autoimmune sykdommer, noe som gjør forståelsen og ideelt sett moduleringen av mekanismen for TLR7-aktivering enda viktigere.
Forskerne, ledet av professor Veit Hornung og Marlene Berouti fra Genetikksenteret i München og Institutt for biokjemi ved LMU, klarte å dykke dypere inn i den komplekse aktiveringsmekanismen. Det var kjent fra tidligere studier at komplekse RNA-molekyler må kuttes slik at reseptoren kan gjenkjenne dem.
Ved å bruke en rekke teknologier, fra cellebiologi til kryoelektronmikroskopi, har forskere ved LMU avdekket hvordan enkelttrådet fremmed RNA behandles for å oppdage TLR7. Arbeidet deres ble publisert i tidsskriftet Immunity.
En rekke enzymer er involvert i gjenkjenning av fremmed RNA
Gjennom evolusjonen har immunsystemet spesialisert seg på å gjenkjenne patogener basert på deres genetiske materiale. For eksempel stimuleres den medfødte immunreseptoren TLR7 av viralt RNA. Vi kan tenke på viralt RNA som lange tråder av molekyler som er for store til å bli gjenkjent som ligander for TLR7. Det er her nukleaser kommer inn i bildet – molekylære skjæreverktøy som kutter «RNA-tråden» i små biter.
Endonukleaser klipper RNA-molekylene på midten, som en saks, mens eksonukleaser kløyver tråden fra den ene enden til den andre. Denne prosessen genererer forskjellige RNA-fragmenter som nå kan binde seg til to forskjellige lommer på TLR7-reseptoren. Først når begge bindingslommene på reseptoren er okkupert av disse RNA-bitene, utløses en signalkaskade som aktiverer cellen og utløser en alarmtilstand.
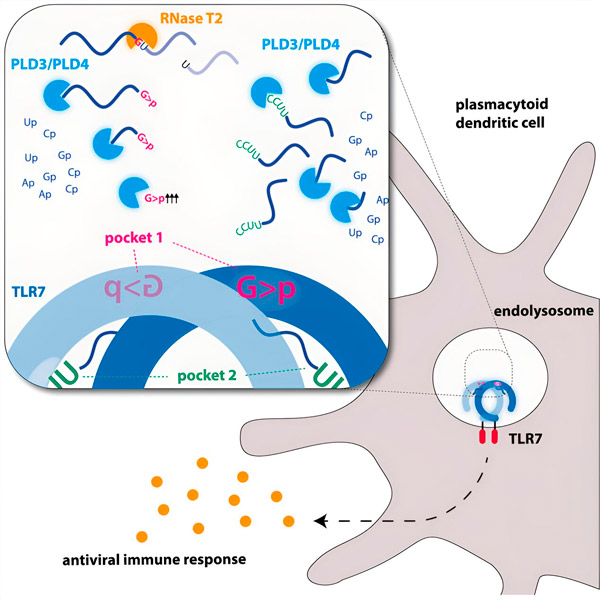
Grafisk bilde. Kilde: Immunity (2024). DOI: 10.1016/j.immuni.2024.04.010
Forskerne fant ut at gjenkjenning av TLR7 RNA krever aktiviteten til endonukleasen RNase T2, som virker sammen med eksonukleasene PLD3 og PLD4 (fosfolipase D3 og D4). «Selv om det var kjent at disse enzymene kunne bryte ned RNA», sier Hornung, «har vi nå vist at de samhandler med og dermed aktiverer TLR7.»
Balansering av immunforsvaret
Forskerne fant også at PLD-eksonukleaser spiller en dobbel rolle i immunceller. Når det gjelder TLR7, har de en proinflammatorisk effekt, mens de, når det gjelder en annen TLR-reseptor, TLR9, har en antiinflammatorisk effekt. «Denne doble rollen til PLD-eksonukleaser indikerer en fint koordinert balanse for å kontrollere riktige immunresponser», forklarer Berouti.
«Samtidig stimulering og hemming av betennelse av disse enzymene kan tjene som en viktig beskyttelsesmekanisme for å forhindre dysfunksjoner i systemet.» Hvilken rolle andre enzymer kan spille i denne signalveien og om de involverte molekylene er egnet som målstrukturer for terapi, vil være gjenstand for videre forskning.
